| |
|
||||||
| |
|
||||||
|
|
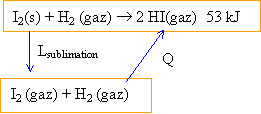
sublimation I2. |
corrigé |
|||||
| |
53 = Q + L sublimation. Q peut être déterminée à partir des énergies de liaisons : Q = S énergies des liaisons rompues -S énergies des liaisons créees Q = E(I-I)+E(H-H)-2E(H-I)= 150 + 432-2*297 = -12 kJ L sublimation = 53 +12 = 65 kJ mol-1.
|
||||||
|
Energie de la liaison N-N |
La chaleur de combustion de H2N-NH2 gazeux est -585 kJ.mol-1.
énergie de liaison en kJ/mol : E(N-H)=388; E(O=O)=494; E(N triple liaison N)=940; E(O-H)=460 corrigé |
||||||
| |
liaisons rompues : N-N et 4 liaisons N-H (4*388 kJ) et 1 liaison O=O (494 kJ) S énergies des liaisons rompues : 2046 + E(N-N) kJ liaisons créees : N triple liaison N (940 kJ) et 4 liaisons O-H (4*460 kJ) S énergies des liaisons créees : 2780 kJ -585 = S énergie des liaisons rompues - S énergies de liaisons créees -585 = E(N-N) + 2046-2780 E(N-N)=149 kJ.
|
||||||
|
butane |
corrigé |
||||||
| |
on cherche à écrire l'équation ci dessus à partir de(1), (2) et (3) - (1) C4H10 donne 4C + 5H2 -Q1 (2) fois 4 : 4C + 4O2 donne 4CO2 4Q2 (3) fois 5 : 5H2 + 5/2O2 donne 5H20 5Q3 Q = -Q1 + 4Q2 + 5Q3 Q= 125-4*393 -5*286 = -2877 kJ / mol. masse molaire du butane : 4*12+10 = 58 g / mol énergie libérée par la combustion de 500 g de butane : 2877 *500 / 58 = 24 801 kJ. le signe moins intervient dans le mot libéré. |
||||||
|
|
|