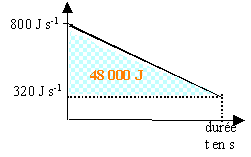| |
|
|||||||||||||||||||
| |
|
|||||||||||||||||||
|
|
le soleil, un réacteur nucléaire |
On peut comparer le Soleil à un réacteur thermonucléaire transformant 564 000 000 t d'hydrogène en 560 000 000 t d'hélium à chaque seconde.
corrigé |
||||||||||||||||||
| |
D m* c²= énergie en joule D m = 5,64 1011 -5,6 1011 = 4 109 kg à chaque seconde. c² = (3 108)² = 9 1016 m² s-2. puissance (watt) = énergie libérée à chaque seconde 3,6 1026 J / s (ou watt) masse perdue depuis qu'il rayonne : à chaque seconde 4 109 kg durée : 5 109 *365*24*3600 = 1,57 10 17 s masse perdue en 5 milliards d'années : 6,3 1026 kg fraction de la masse du soleil : 6,3 1026 / 2 1030 = 0,03 %.
|
|||||||||||||||||||
|
chauffe-eau solaire |
corrigé |
|||||||||||||||||||
| |
100*4,2*(75-25) = 2,1 104 kJ. 0,5 kW ou kJ / s est utilisé au chauffage de l'eau. 0,5 = 4,18*(75-25)*débit massique (kg s-1) débit massique = 2,4 10-3 kg / s ou 8,6 L / h durée du chauffage : 100 / 8,6 = 11,6 h.
|
|||||||||||||||||||
|
un autre chauffe eau |
Sur la notice d'un petit chauffe-eau instantané on peut lire: - puissance: 125 millithermie par minute (125 mth/min); - débit: 5 litres d'eau par minute à 40 degrés C.
|
|||||||||||||||||||
| |
125*4,18 103= 5,225 105 J / min = 522,5 kJ / min 5 * 4,18 * différence de température = 522,5 différence de température = 25° soit 40-25=15°C. Le débit est divisé par 2 donc la différence de température va doubler soit 50°C puis ajouter 15° pout trouver la température de l'eau chaude : 65°C.
|
|||||||||||||||||||
|
champagne |
On cherche à refroidir une bouteille de champagne d'une température initiale T=20°C à une température T=8°C. On la place dans un mélange eau glaçon à 0°C. Quel temps faut il pour refroidir la bouteille de surface 500cm2 et de chaleur spécifique 4 kJ / K. coeff d'échange convectif eau bouteille: 800W m-2 K-1. corrigé |
|||||||||||||||||||
| |
4*(20-8)= 48 kJ. 0,8 kW (ou kJ s-1) sont échangés par une surface de 1 m² 500 cm² =5 dm² =0,05 m² 0,05*0,8 =0,04 kJ s-1 ou 40W échangé par la bouteille pour une différence de température de 1°C. initialement la bouteille est à 20 °C et le mélange eau glaçon reste à O°C. en conséquence durant la première seconde , 40*20 =800 J sont échangés. finalement la bouteille est à 8°C et le mélange eau glaçon est à 0°C en conséquence durant la dernière seconde , 40*8 =320 J sont échangés.
soit 48 000 = (800-320)*t / 2 d'où t = 200 s.
|
|||||||||||||||||||
|
transformer de la glace en vapeur d'eau |
-20°C en vapeur à 100°C ? chaleur latente de fusion de la glace à °C : 335 kJ kg-1. chaleur latente d'ébullition de l'eau :2 270 kJ kg-1. capacité thermique massique kJ kg-1 K-1 :eau 4,2 ; glace 2,1.
|
|||||||||||||||||||
| |
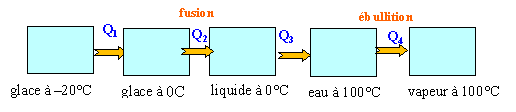
Q1 = 0,01 *2,1*(0 -(-20))= 0,42 kJ Q2 : changement d'état ( fusion ) à température constante 335*0,01 =3,35 kJ Q3 : 10 g de liquide se réchauffe de 0 à 100°C 0,01*4,2*100 = 4,2 kJ Q4 : changement d'état ( ébullition ) à température constante 2 270*0,01 = 22,7 kJ total : 30,67 kJ.
|
|||||||||||||||||||
|
capacité thermique d'un calorimètre |
Dans un calorimetre on place masse m1 d'eau. On attend l'equilibre thermique, puis on relève la température d'equilibre q1. On introduit une masse m2 de cuivre sortant d'une étuve thermostatée à la temperature q2. On attend l'équilibre thermique, on relève la température d'équilibre q3. On recomence l'expérience en changeant la masse m1, q1, q2 et q3.
thermique Ccal du calorimetre et de ses accessoires, m1, q1, q2 et q3. On a relevé les resultats suivants:
corrigé |
|||||||||||||||||||
| |
(Ccal + m1 Ceau)( q3-q1) énergie cédée par le cuivre : m2 Ccuivre( q3-q2) pas de pertes vers l'extérieur : (Ccal + m1 Ceau)( q3-q1) + m2 Ccuivre( q3-q2) =0 application numérique : (Ccal + 0,125*4180)(20,6-16,5)+0,118 Ccuivre(20,6-88)=0 (Ccal + 522,5)*4,1- 7,95 Ccuivre = 0 (Ccal + 522,5)*0,516 - Ccuivre = 0 (1) (Ccal + 0,1*4180)(23,7-20)+0,118 Ccuivre(23,7-75)=0 (Ccal + 418)*3,7- 6,05 Ccuivre = 0 (Ccal + 418)*0,611 - Ccuivre = 0 (2) (2) -(1) donne : 0,095 C cal =14,21 d'où C cal = 150 J C-1. repport de cette valeur dans (1) : (150+522,5)*0,516= C cuivre = 347 J kg-1 C-1 en accord à 10% près
|
|||||||||||||||||||
| |
De la vapeur d'eau, à la température de 100°C et sous la pression de 1 bar, est introduite dans un serpentin baignant dans de l'eau. La vapeur se condense.
Données : Ceau=4,18 kJ.kg-1.°C-1 ; Leau= 2 260 kJ.kg-1. corrigé La vapeur se condense et cède de l'énergie au serpentin et à l'eau qui l'entoure. débit : 0,25 L en 60 secondes soit 0,25 / 60 = 4,17 10-3 L/s ou encore 4,17 10-3 kg/s. On détermine l'énergie cédée par la vapeur d'eau puis par l'eau qui en résulte durant une seconde, ce qui revient à déterminer une puissance en watt ou joule / seconde. D'une part la vapeur d'eau se liquéfie et donne de l'eau liquide à 100°C, en libérant 2660 kJ par kg de vapeur soit 2660* 4,17 10-3 = 11,1 kJ/s d'autre part le liquide chaud se refroidit de 100°C à 80 °C libérant chaque seconde : m Ceau Dq = 4,17 10-3 *4,18*20 = 0,35 kJ/s soit au total :
11,1+0,35 = 11,45 kJ/s ou 11,45 kW.
|
|||||||||||||||||||
| |
10g de vapeur d'eau à 100°C sont injectés sur 50 g de glace à 0°C. Quelle sera la température à équilibre? chaleur latente (kJ kg-1): eau:Lf=333,5 Lv=2258 Chaleur spécifique (kJ kg-1 K-1): eau=4,185 ; glace=2,093 corrigé la vapeur se condense et donne de l'eau liquide à 100 °C énergie cédée Q1 = 0,01*2258 = 22,58 kJ le liquide se refroidit de 100 à q °C énergie cédée : Q2 = 0,01*4,18*(100-q) = 4,18 -0,0418 q total libérée par les corps chauds :Qchaud = 22,58 + 4,18 -0,0418 q = 26,76 -0,0418 q kJ énergie nécessaire à la fonte de0,05 kg de glace à 0°C 0,05*333,5 = 16,67 kJ l'eau de fonte se réchauffe de 0 à q °C énergie mise en jeu : 0,05*4,18 q = 0,209 q énergie totale gagnée par les corps froids : Qfroids=16,67 + 0,209 q systéme supposé adiabatique : l'énergie cédée par les corps chauds est gagnée par les corps froids 26,76 -0,0418 q = 16,67 + 0,209 q 10,09 =0,251 q ;q =10,09 / 0,251 = 40,2
°C.
|
|||||||||||||||||||
| |
corrigé Augmentation de longueur DL du pont : Lq = L0(1+a(273+q)) Lq1 = L0(1+a(273+q1)) ; Lq2 = L0(1+a(273+q2)) ; DL = Lq2 -Lq1 =L0a[q2-q1] DL =100*12
10-6 (50+20) = 0,084 m = 8,4 cm.
Energie Qc cédée par le corps chaud, l'aluminium : Qc =maca(q éq-q a) Energie Qf gagnée par les corps froids, l'eau et le calorimètre : Qf =(me+m)ce(q éq-q e) système adiabatique, sans échange de chaleur avec l'extérieur : Qc + Qf = 0 maca(q éq-q a) + (me+m)ce(q éq-q e) =0 ca = (me+m)ce(q éq-q e) / [ma(q a-q éq) ] ca = 0,24*4185*(33-21,1) / (0,199*67)= 896 J kg-1 K-1.
|
|||||||||||||||||||
| |
Un appareil à cire est constitué d'une cuve en aluminium de masse 0,25 kg chauffé par une résistance thermo-régulée.La puissance électrique de cet appareil est 200 W. La cuve contient 500 g de cire, ressolidifiée après fusion et épousant la forme de la cuve. L'ensemble est à la température ambiante de 18°C. Cette cire dite "tiède" commence à fondre à 37°C. Le début de la fusion est observé au bout de 2 min 10 s.
corrigé Capacité thermique massique, notée c, de la cire solide : énergie électrique reçue en Dt =2 min 10 s = 130 s : Q1= P Dt =200*130 = 2,6 104 J énergie reçue par la cire : Q= m c Dq =0,5 c* (37-18) = 9,5 c énergie reçue par l'aluminium : Q' = m Al cAl Dq = 0,25*895*(37-18) =4,25 103 J Q1 = Q+Q' ; 2,6 104 = 9,5 c + 4,25 103 ; c = ( 2,6 104-4,25 103)/ 9,5 = 2289 J kg-1 K-1.
Cette cire n'étant pas un corps pur, sa température de fusion n'est pas constante. Quantité de chaleur nécessaire à cette seconde étape : P Dt = 200*12*60 = 1,44 105 J Quantité de chaleur nécessaire à la fusion de 1 kg de cette cire : 2*1,44 105 = 2,88 105 J kg-1. |
|||||||||||||||||||
|
|
|