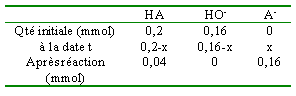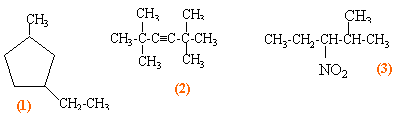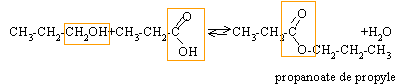|
|
|
|
acide faible base forte |
On mélange 20 mL d'un acide faible HA à 0,01 mol L-1 et 16 mL d'hydroxyde de sodium à 0,01 mol L-1. Le pH du mélange est égal à 4,8. Dans la liste suivante choississez le ou les acides utilisés en justifiant.
corrigé |
|
quantité de matière initiale des réactifs : HA : 20*0,01 =0,2 mmol et HO- : 16*0,01 = 0,16 mmol
pH = pKa+ log [A-] / [AH] 4,8 = pKa + log(0,16 / 0,04) d'où pKa= 4,2 ou Ka= 10 exposant (-4,2)=6,3 10-5. acide benzoïque |
|
|
dosage redox |
On effectue le dosage de 10 mL d'acide oxalique (COOH)2 par une solution de permanganate MnO4- à 0,01 mol L-1. MnO4- / Mn2+ 1,51 V ; CO2 / (COOH)2 -0,49 V.
corrigé |
|
5{ (COOH)2 --> 2CO2 +2 e- + 2H+ } oxydation 2MnO4- + 6H+ + 5 (COOH)2 --> 10CO2 + 2Mn2+ + 8H2O la différence entre les potentiels redox étant de 2 V , la réaction sera totale. Les réactifs sont en quantités stoéchiomètriques. permanganate : 6*0,01 = 0,06 mmol
x=0,06*5 / 2 =0,15 mmol acide oxalique dans 10 mL concentration : 0,015 mol L-1.
|
|
|
nomenclature |
Ecrire les formules développées de chacun des composés suivants : 2,2,3-triméthylbutane ; 4-ethyl-3-méthylheptane ; phénylacétate d'éthyle
|
|
3,3,5,5-tétraméthylhex-3-yne 2-méthyl-3-nitropentane
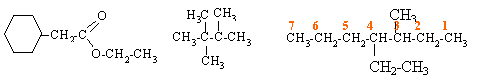
|
|
|
|
|
|
cinq produits oxygénés inconnus |
On possède 5 flacons contenant les produits notés A, B,C, D, E tous différents. On ne connait pas leur nom mais on sait que : * chaque produit est un corps pur et sa molécule ne contient que 3 atomes de carbone, des atomes d'hydrogène et des atomes d'oxygène. * la chaine carbonnée ne contient pas de liaisons multiples. * parmi les 5 composés il y a deux alcools.
|
|
A est le propan-1-ol : CH3-CH2-CH2OH C , D : le propanal ou l'acide propanoïque Un alcool secondaire donne par oxydation ménagée une cétone. B est le propan-2-ol : CH3-CHOH-CH3. E est la propanone : CH3-CO-CH3. Un aldehyde est un réducteur : C est le propanal CH3-CH2-CHO D est l'acide propanoïque CH3-CH2-COOH 2{ Cr2O72- +6 e- + 14H+ --> 2Cr3+ + 14H2O } réduction 3{ C2H5CH2OH + H2O --> C2H5COOH + 4 e- + 4H+ } oxydation 2Cr2O72- + 3C2H5CH2OH + 16H+ --> 4 Cr3+ + 3C2H5COOH + 11H2O estérification : lente, athermique, limitée par l'hydrolyse de l'ester.
|
|
|
|
|