Dans une fiole jaugée de 500 ml on prépare une solution S contenant 0,1 mol de chlorure d'hydrogène, 0,05 mol d'hydroxyde de sodium et 0,1 mol de méthanoate de sodium. Données pKa du couple HCOOH/HCOO- = 3,8
Quelle(s) est (sont) l'(es) affirmation(s) exacte(s) ?
- la première réaction prépondérante qui a lieu s'écrit : H3O+ + HO- --> 2H2O
- la constante d'équilibre de la seconde réaction prépondérante a pour valeur Kr= 6,3 103.
- Il n'y a quasiment pas de réaction entre les ion méthanoate et les molécules d'eau.
- le pH de la solution S est égal à 3,8.
- La dilution au 1/10 de la solution S augmente le pH de 1 unité.
corrigé
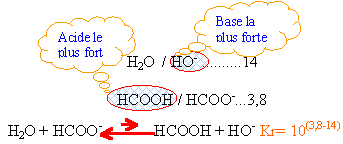
H2O / HO- ..........14
HCOOH / HCOO-...3,8
H3O+ / H2O .....0
HO- + H3O+ --> 2H2O
l'acide le plus fort réagit naturellement avec la base la plus forte
la constante de cette réaction est égale à 1014.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
acide / base..........pKa
HCOOH / HCOO-...3,8
H3O+ / H2O .....0
HCOO- + H3O+ --> H2O + HCOOH
l'acide le plus fort réagit naturellement avec la base la plus forte
la constante de cette réaction est égale à 103,8= 6,3 103.
dans le cas d'une réaction naturelle, l'exposant est égal à la différence positive des pKa
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
La solution finale contient HCOOH et l'ion méthanoate, la base conjuguée de HCOOH, en quantité égale: c'est une solution tampon dont le pH est égal au pka du couple acide base. pH=pKa= 3,8.
Le pH de cette solution n'est pas modifié lors d'une dilution au 1/10.