On remplit un tube en U d'une solution acidifiée de chlorure d'étain (II) de concentration 0,1 mol.L-1. On plonge une électrode en graphique de chaque côté du tube en U. On impose une tension entre les deux électrodes à l'aide d'un générateur de tension continue et réglable.
- Faire un schéma de l'expérience en indiquant en particulier le sens du courant ainsi que l'anode et la cathode.
- Indiquer le produit de la réaction obtenu à chaque électrode.
- Ecrire l'équation de la réaction observée à chaque électrode et l'équation-bilan de l'électrolyse.
corrigé
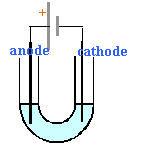
sens du courant : sort de la borne positive de la pile.
cathode signifie réduction : Sn2+ + 2e- donne Sn métal.
anode signifie oxydation : 2Cl- donne Cl2 +2e-
bilan : Sn2+ + 2Cl- donne Sn + Cl2.
Vous disposez d'une solution commerciale d'acide chlorhydrique dont l'étiquette indique :
densité par rapport à l'eau d= 1,18 pourcentage massique en chlorure d'hydrogène dissous : 35 %
masse molaire du chlorure d'hydrogène : 36,5 g/mol. Calculez :
- la masse m d'un volume V=1L de cette solution.
- la masse m' de chlorure d'hydrogène dissous dans le même volume.
- la concentration C en chlorure d'hydrogène dissous dans cette solution ( avec une décimale).
- A l'aide de cette solution commerciale, on vous demande de préparer 100 mL d'une solution A de concentration Ca = 0,5 mol/L. Calculez le volume v (en mL avec une décimale) de la solution mère que vous devrez prélever.
- Dressez la liste du matériel necessaire. Décrivez le protocole opératoire de votre préparation.
corrigé
1180 grammes par litre soit 1180*0,35 = 413 g HCl dissout ou 413 / 36,5 = 11,31 mol L-1.
volume pipette(mL)* concentration de la solution mère = volume fiole jaugée (mL) * concentration finale
volume pipette = 100*0,5 /11,3 = 4,4 mL
prélever 4,4 mL à la pipette + pipeteur
placer dans fiole jaugée de 100 mL
compléter avec de l'eau distillée.
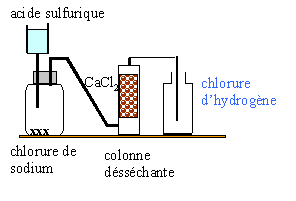
- Rappelez les formules : de l'acide sulfurique, du chlorure de sodium, du chlorure de calcium,
- Quel est le rôle de la colonne desséchante ?
- Pourquoi le chlorure d'hydrogène n'est-il pas recuelli sur une cuve à eau ?
- Pourquoi le flacon destiné à recueillir le chlorure d'hydrogène a-t-il son ouverture tournée vers le haut ?
- Citez une autre méthode de préparation du chlorure d'hydrogène.
- Légendez le schéma ci-dessous en
utilisant les termes suivants : eau / chlorure
d'hydrogène / acide chlorhydrique
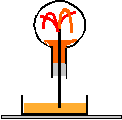
- On met quelques gouttes d'hélianthine dans la cuve. Quelle est alors sa couleur / Justifiez
- Que devient cette couleur dans le ballon ? Justifiez.
corrigé
la colonne désséchante élimine l'eau entrainée par le gaz HCl.
Le chlorure d'hydrogène très soluble dans l'eau ne peut pas être recueilli sur la cuve à eau.
Le chlorure d'hydrogène a une densité supérieur à celle de l'air, il occupe la partie basse du récipient.
L'eau + hélianthine (orange vers pH=7)sont dans le cristallisoir, le chlorure d'hydrogène est dans le ballon.
Le chlorure d'hydrogène se dissout dans l'eau : il en résulte une dépression dans le ballon et une aspiration du liquide.
L'acide chlorhydrique résulte de la dissolution du chlorure d'hydrogène dans l'eau :
l'hélianthine est rouge en milieu acide.
On vous demande de déterminer la concentration molaire Cb d'une solution aqueuse B de soude (hydroxyde de sodium), en présence d'un indicateur coloré. Pour cela vous doserez cette solution B par la solution A d'acide chlorhydrique préparée au paragraphe précédent.
- Ecrivez l'équation de la réaction entre les solutions A et B.
- Quel indicateur coloré devez-vous choisir ? Justifiez votre réponse.
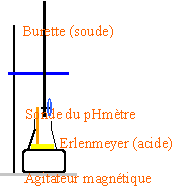
- Vous prélevez un volume Va=10 mL de solution A que vous placez dans un erlenmeyer.
- Pourquoi utilisez vous un erlenmeyer plutôt qu'un bécher ?
- Faites un schéma légendé du montage.
- Vous versez la soude jusqu'au virage de l'indicateur. Vous notez alors le volume correspondant Vb=20 mL.
- Calculez la concentration Cb de la solution B.
corrigé
dosage acide fort base forte : pH=7 à l'équivalence.
La zone de virage de l'indicateur coloré doit contenir cett valeur pH=7 donc bleu de bromothymol
H3O+ +HO- donne 2H2O
La forme tronconique de l'elenmeyer est préférable à la forme cylindrique du bêcher (pas de perte de matière)
A l'équivalence acide base CaVa=CbVb (monoacide et monobase)
0,5*10=20*Cb
Cb=0,25 mol L-1.
Dans l'inventaire de votre laboratoire, vous retrouvez cinq flacons qui ont perdu leurs étiquettes. Par déduction vous savez qu'il s'agit de propan-1-ol, de propanal, d'acide propanoïque, de butanone, et de 2-méthylpropan-2-ol.
- Donner la formule semi-développée, la fonction et la classe éventuelle de chacun des composés cités.
- Soit A, B, C, D, E les cinq produits à identifier. Vous les testez d'abord à la D.N.P.H pour les classer en deux groupes : le groupe I constitué de A et B qui donnent un précipité jaune, le groupe II constitué de C,D et E qui ne donnent pas de précipité.Conclusions ?
- Vous testez ensuite les deux groupes avec une solution acide de permanganate de potassium violette : dans le groupe I, A donne une décoloration et B ne réagit pas, dans le groupe II, C donne une décoloration. D et E ne réagissent pas. Conclusions ?
- Vous testez enfin D et E avec du papier pH : D est nettement plus acide, E est pratiquement neutre. Conclusions ?
- On fait réagir l'acide propanoïque sur le 2-méthylpropan-2-ol : donnez la formule semi-développée et la famille du composé organique obtenu.
- On fait réagir l'acide propanoïque sur
l'ammoniac : donnez la formule
semi-développée et la famille du
composé organique obtenu après chauffage.
corrigé
propanal : CH3-CH2-CHO aldehyde
acide propanoïque: CH3-CH2-COOH
butanone : CH3-CH2-CO-CH3 cétone
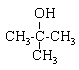
2-méthylpropan-2-ol : alcool secondaire
A et B : propanal et butanone possédant le groupe carbonyl CO
C, D et E, les deux alcools et l'acide.
A est l'aldehyde qui s'oxyde en acide propanoïque.
C est l'alcool primaire qui s'oxyde en aldehyde puis en acide carboxilique.
D est l'acide propanoïque .
ester : propanoate de 1-méthyléthyle
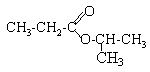
amide : propanamide
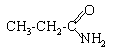
Un professeur a réalisé un montage à l'aide d'un amplificateur opérationnel. Une tension triangulaire est appliquée à l'entrée du montage. Les voies A et B d'un oscilloscope visualisent respectivement les tensions d'entrée Ue et de sortie Us. La face avant de cet oscilloscope est représentée ci-dessous :
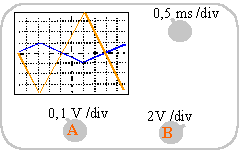
- Sans faire de calcul, pouvez-vous dire si les tensions Ue et Us ont la même période ? Justifiez votre réponse. Calculez la période T et la fréquence f de la tension Us.
- Justifiez sans calcul, le fait que le montage est amplificateur. Ce montage est-il inverseur ou non-inverseur ? Justifiez.
- Calculez les amplitudes des tensions Ue et Us. Calculez le facteur d'amplification A.
- L'alimentation de l'amplificateur opérationnel se fait par un générateur (+15V ; V ; -15V). Donner l'ordre de grandeur de la tension de saturation Usat . Justifiez votre réponse.
- On vous demande alors de préparer un tel montage comportant deux conducteurs ohmiques de résitance R1 et R2. Faire la liste du matériel nécessaire.
- Faites le schéma complet du montage que vous allez réaliser. Donnez sans démonstration l'expression du facteur d'amplification en fonction de R1 et R2. La résistance R1 valant 1000 ohm, déduisez la valeur de R2.
corrigé
Les 2 courbes ont la même période: 8 divisions soit 4 ms =4 10-3 s
fréquence 1/4 10-3 =250 Hz.
l'amplitude de la tension de sortie est 4 fois plus grande que l'amplitude de la tension d'entrée.
Montage inverseur : lorsque la tension d'entrée passe par un maximum, la tension de sortie passe par un minimum.
amplitude Ue : 1 div *0,1 =0,1 V
amplitude Us :4 div * 2=8 V
inverseur : -8/0,1 = -80.
l'amplitude de la tension de sortie ne peut pas être supèrieure à 15V.
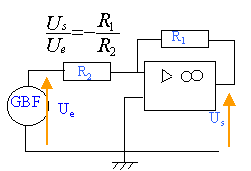
ajouter le générateur +15 -15V au montage
-1000 / R2 = -80 d'où R2=12,5 ohms.
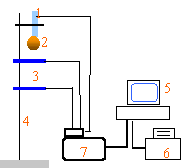
- Légendez ce schéma en utilisant les termes suivants : imprimante / capteur / règle / bille / interface / ordinateur / cellules photélectriques
- Quels sont les rôles du capteur ? de l'interface ? du logiciel ? Que signifie le sigle EXAO ?
- Après avoir réalisé plusieurs enregistrements , l'écran de l'ordinateur affiche le tableau suivant :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
b) Le mouvement de chute de bille est-il uniforme ? Pourquoi ?
c) Calculer la vitessse moyenne de la bille entre les enregistrements n°3 et n°8.
Après avoir choisi l'option "représentation graphique", vous obtenez l'écran suivant :
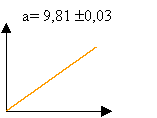
De quel graphe s'agit-il ? Quelle est la nature du mouvement de chute de la bille ? Justifiez votre réponse. Que représente l'indication a ? Que représente la valeur +9.810 ? Précisez son unité . Que représente la valeur +0.03 ? Précisez son unité .
corrigé
(1) : capteur de départ + électroaimant ; (2) : bille
(3) : cellules photélectriques (4) : règle (5) : ordinateur
(6) : imprimante (7) : interface
capteur : transforme un signal optique en signal électrique
interface : converti un signal analogique en numérique
logiciel : assure le traitement des données reçues
EXAO expériences assistées par ordinateur
t : temps (s) ; h : distance parcourues (m) et v : vitesse (ms-1)
distance et temps ne sont pas proportionnelles donc le mouvement n'est pas uniforme.
vuitesse moyenne = distance parcourue / durée du parcours
(0,7-0,2) / (0,374 - 0,1976) =2,83 ms-1.
graphe : vitesse en fonction du temps
v = a t donc h = 0,5 g t², mouvement uniformément accéléré.
a représente l'accélération de la pesanteur en m s-2.
+ ou - 0,03 représente la précision du résultat
On réalise une expérience à l'aide d'un haut-parleur branché sur un générateur basse fréquence, de deux microphones M1 M2 respectivement branchés sur les voies 1 et 2 d'un oscilloscope.On déplace sur une même direction de propagation du son, M2 par rapport à M1 qui reste fixe tout au long de l'expérience. On relève la première position rencontrée pour laquelle les deux oscillogrammes sont en opposition de phase, soit M'1M'2=19 cm ; puis la première position pour laquelle les deux oscillogrammes (voir schéma ci-dessous) sont en phase, soit M''1M''2 = 38 cm.
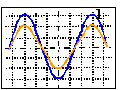
- Déterminer l'amplitude du signal reçu en M2
- Déterminer la fréquence et la période du son émis par le haut parleur.
- Déterminer la longueur d'onde du signal sonore.
- Déduire de ces valeurs la célérité du son.
- On éclaire le haut-parleur à l'aide d'un stroboscope sans modifier les réglages précédents.Proposer 3 valeurs de fréquence des éclairs permattant d'obtenir l'immobilité apparente du haut-parleur.
corrigé
amplitude en M2= 2/3 de l'amplitude en M1.
période : 6 divisions soit 6*0,2 =1,2 ms =1,2 10-3 s
fréquence 1/ 1,210-3 = 833 Hz
longueur d'onde : 0,38 m
célérité du son d'ans l'air : 0,38*833 = 316 ms-1.
fréquence des éclairs : 833 Hz et sous multiples.