|
avec calculatrice |
||||||||||||||||
|
||||||||||||||||
|
|
On réalise une pile à partir des couples Zn2+ / Zn et Ni2+ / Ni . Chaque solution a pour volume V= 100 mL et la concentration initiale en ion positif est c= 0,05 mol/L. données : Zn=65,4 ; Ni = 58,7 g/mol ; rZn=7 g/cm3 ; constante d'Avogadro : 6,02 1023 mol-1 ; e = 1,6 10-19 C ; 1 F = 96500 C ; pour la réaction Ni2+ + Zn = Zn2++ Ni la constante d'équilibre K vaut K=1018. I- Réalisation de la pile :
II- Etude de la pile : On fait débiter la pile dans un conducteur ohmique.
III- Décharge partielle de la pile : on prend une deuxième pile identique et on laisse fonctionner pendant une heure. On suppose l'intensité constante. On constate une augmentation de masse de l'électrode de nickel de 100 mg.
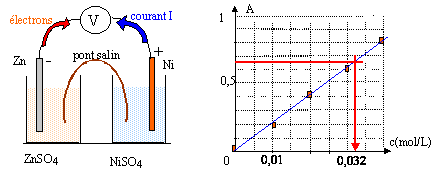
Les électrons se déplacent dans les électrodes et dans le circuit extérieur. Ni2+ + 2e- = Ni(s) réduction de Ni2+ à la cathode positive Zn(s) = Zn2+ + 2e- oxydation à l'anode négative bilan : Ni2+ + Zn(s) = Zn2+ +Ni(s) Qr,i = [Zn2+]i / [Ni2+]i= c / c = 1 Qr,i est très inférieur à la constante d'équilibre K : donc évolution spontanée dans le sens direct. [Ni2+]i diminue et [Zn2+]i augmente au cours du fonctionnement de la pile : donc Qr augmente et se rapproche de K La pile s'arrête lorsque l'un au moins des réactifs a disparu : ici l'ion Ni2+ ( car Zn(s) est en excès) Qr,fin = K xmax =quantité initiale du réactif limitant ( l'ion nickel II) xmax = concentration (mol/L) fois volume solution (L) = 5 10-2 * 0,1 = 5 10-3 mol. Or Ni2+ + 2e- = Ni(s) don Qté de matière d'électrons = 2 fois Qté de matière d'ion nickel II ne- = 2*5 10-3 = 10-2 mol. La charge d'une mole d'électrons est 96500 C soit Q= 96500*0,01 = 965 C. Qté de matière de nickel métal apparu = Qté de matière d'ion nickel II disparu Qté de matière (mol) =masse (g) / masse molaire Ni (g/mol)= 0,1 / 58,7 = 1,7 10-3 mol Qté de matière d'électrons : ne- = 2* 1,7 10-3 = 3,4 10-3 mol. Quantité d'électricité Q = 96500*3,4 10-3 = 328,1 C. Q (coulomb)= I(ampère) * t( seconde) d'où I = Q/t = 328,1 / 3600 = 0,091 A. [Ni2+] = 0,032 mol/L d'après le graphe ci-dessus. soit 0,032*0,1 = 3,2 10-3 mol d'ion nickel restant. initialement : 5 10-3 mol a réagi : 5 10-3 -3,2 10-3 = 1,8 10-3 mol. conforme avec le résultat trouvé ci-dessus : 1,7 10-3 mol
|
|||||||||||||||
|