|
sans calculatrice |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
|
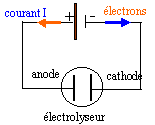
Le zinc est préparé par électrolyse d'une solution de sulfate de zinc acidifiée à l'acide sulfurique. les ions sulfates ne participent pas à la réaction. On observe un depôt métallique à l'une des électrodes et un dégagement gazeux sur l'autre. données : Zn=65 g/mol ; rZn=7 g/cm3 ; constante d'Avogadro : 6,02 1023 mol-1 ; e = 1,6 10-19 C ; 1 F = 96500 C environ 105 C ; 65*8*48*36 environ 9 105 ; 8*48*36 environ 14 000 ; 65*48 / (8*36) environ 10 ; 8*48/36 environ 10. I- Etude de la transformation :
II- Exploitations : l'électrolyse a lieu sous 3,5 V. L'intensité du courant peut atteindre 80 kA. Après 48 heures de fonctionnement, le dépôt de zinc est suffisamment épais et il est alors séparé de l'électrode, fondu et coulé en lingots.
Zn2+ migre vers la cathode négative et se réduit : Zn2+ + 2e- = Zn (s) H+ migre vers la cathode négative et peut se réduire : 2H+ + 2e- =H2 (g), réaction concurente de la précédente. ( la masse théorique de zinc sera donc supérieure à la masse réelle) les molécules d'eau sont présentes à la cathode et peuvent se réduire en H2. SO42- migre vers l'anode positive : pas d'oxydation de l'ion sulfate l'eau est présente à l'anode et s'oxyde : H2O = ½ O2 + 2H+ + 2e- . équation de la transformation : Zn2+ + H2O =Zn(s) + ½O2 + 2H+ . L'électrolyse est une transformation forcée : l'énergie electrique fournie est convertie en énergie chimique ; une petite partie est perdue sous forme de chaleur. vérification théorique : le quotient de la réaction Qr est supérieur à la constante d'équilibre K : donc pas de réaction spontanée dans le sens direct.
Q= It = 96500 ne- . Q= 8 104 * 24*2*3600 = 8*36*48 106 = 1,4 1010 C ne- = 1,4 1010 / 96500 voisin de 1,4 1010 / 105 = 1,4 105 mol d'électrons soit x = 1,4 105 / 2 = 7 104 mol. Qté de matière de zinc : 7 104 mol masse de zinc : 7 104 * masse molaire = 7 104 *65 = 4,55 106 g = 4,55 t. volume O2 = Qté de matière dioxygène * volume molaire des gaz v = ½x *24 = 12 x = 12*7 104 = 8,4 105 L = 840 m3.
|
|||||||||||||||||||||||
|