|
avec calculatrice |
||||||
|
||||||
|
|
La pile à combustible a été découverte par W Growe en 1839
mais leur utilisation réelle date des années 1960 par la NASA. Ces
piles alimentaient en électricité les ordinateurs de bord des vaiseaux
Gemini et Apollo et fournissaient l'eau de consommation. Ces piles
présentent deux avantages par rapport aux piles alcalines, utilisant
des réactifs abondants ( dioxygène de l'air et dihydrogène) et être non
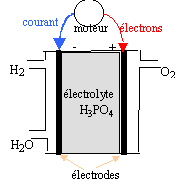
polluantes car libérant de l'eau. données : O=16 ; H=1 g/mol ; constante d'Avogadro : 6,02 1023 mol-1 ; e = 1,6 10-19 C ; 1 F = 96500 C. I- Schéma de la pile : 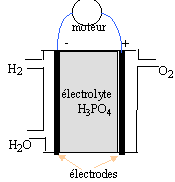
II- couples redox : les couples mis en jeu sont H+ / H2(g) et O2(g) / H2O(l).
III- le combustible : c'est le réactif qui est oxydé.
IV- le véhicule : dans un véhicule motorisé utilisant une pile à combustible, on estime à 250 kg la masse de dihydrogène nécessaire pour parcourir 250 km.
V- la navette : dans la navette spatiale, les piles débitent un courant d'intensité I=200 A.
H2 = 2H+ + 2e- ; oxydation à l'anode ( par définition l'anode est l'électrode où se produit l'oxydation) des électrons sont libérés lors de l'oxydation du dihydrogène : l'anode est la borne négative de la pile. ½O2 +2H+ + 2e- = H2O ; réduction à la cathode positive bilan : H2 + ½O2 = H2O Le combustible est le dihydrogène . dans une réduction, l'oxydant qui se réduit, gagne des électrons. 1,5 kg = 1500 g ; MH2 = 2 g/mol Qté de matière de dihydrogène : 1500 / 2 = 750 mol. volume de ce gaz ( sous un bar et à 20°C) : 750 *volume molaire des gaz = 750 * 24 = 18000 L = 18 m3. ce volume est trop important pour être embarqué dans le véhicule dans les conditions P= 1bar et t=20)C. On peut réduire le volume en stockant le gaz dans un récipient sous pression : PV=nRT s'écrit V= nRT/P à n et T constants le volume et la pression sont deux grandeurs inversement proportionnelles. Q(coulomb) = I(ampère) * temps (seconde) = 96500 * Qté de matière d'électrons (mol) La charge d'une mol d'électrons étant égale à 96500 C ne- = It / 96500 = 200 *24*3600/96500 = 179 mol d'électrons or H2 = 2H+ + 2e- d'où nH2= ½ ne- = 179*0,5 = 89,5 mol de dihydrogène.
|
|||||
|