|
avec calculatrice |
||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
Transformation lente, totale, de décomposition de l'eau oxygénée par les ions iodures en présence d'acide sulfurique. La solution de diiode étant colorée, la transformation est suivie par spectroscopie :mesure de l'absorbance de la solution, grandeur proportionnelle à la concentration en diiode. I- étude théorique :
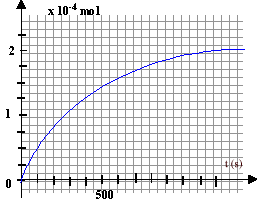
II- suivi de la réaction : à la date t=0 on mélande 20 mL d'une solution d'iodure de potassium ) 0,1 mol/L acidifiée par l'acide sulfurique en excès, 8 mL d'eau et 2 mL d'eau oxygénée à 0,1 mol/L.
H2O2 + 2H++2e- = 2H2O réducteur : espèce, ion ou molécule susceptible de céder des électrons 2I-= I2+2e-. KI : 20 10-3 * 0,1 = 2 10-3 mol H2O2
: 2 10-3 * 0,1 = 2 10-4 mol
2 10-4 -xmax = 0 soit xmax = 2 10-4 mol ( H2O2 en défaut) 2 10-3 -2xmax = 0 soit xmax =10-3 mol (I- en excès) [I2]fin
= 2 10-4 / ((20+8+2)10-3)= 6,66 10-3
mol/L.
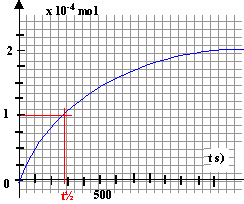
H2O2 : 10-4 mol ; I- : 2 10-3 -2*10-4 = 1,8 10-3 mol ; I2 : 10-4 mol ; La vitesse décroît au cours du temps ( le coefficient directeur de la tangente à la courbe diminue avec le temps) du fait de la diminution des quantités de matière des réactifs. t½ : temps au bout duquel l'avancement x est égal à la moitié de l'avancement final ( la moitié du réactif limitant a alors disparu).
|
|||||||||||||||||||||||||||||||||||||||||||
|