|
|
||||||
|
||||||
|
|
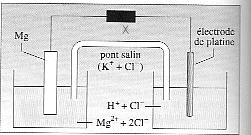
perte facile d'un électron par Na (K2L8M1) pour donner Na+. perte facile de 2 électrons par Mg (K2L8M2) pour donner Mg2+. K = [Mg2+][H2(aq)] / [H+]² = 1075. Qinit = 10-5*10-5 / (10-2)² = 10-6. Qinit< K, donc évolution dans le sens direct ( de gauche à droite) s = l(H+) [H+] + l(Cl-) [Cl-]+ l(Mg2+) [Mg2+] concentration exprimée en mol m-3. les ions HO- sont minotitaires à pH=2 les ions chlorures proviennent essentiellement de l'acide chlorhydrique. [H+] = 0,01 mol/L = 10 mol m-3. [Cl-] voisin [H+] ; [Mg2+] = 10-5 mol/L = 10-2 mol m-3. s = 10-3( 35*10 + 7,6 *10 + 0,6 *0,01) = 0,426 S m-1. au cours de la réaction H3O+ disparaît, Mg2+ apparaît ; mais l(H+) très supérieure à l(Mg2+) donc s diminue. Mg s'oxyde : Mg = Mg2+ + 2e-. c'est l'anode : des électrons sont libérés, c'est l'électrode négative de la pile qu'i faut relier à la borne COM du voltmètre. Mg2+ apparaît dans la demi pile de gauche : pour maintenir l'électroneutralité de la solution, des ions Cl- migrent du pont salin vers la gauche. A la cathode positive, réduction 2H+ +2e- = H2(aq) les électrons circulent dans le circuit extérieur (fil de cuivre) jusqu'au platine H+ disparaît dans la demi-pile de droite : pour maintenir l'électroneutralité de la solution, des ions K+ migrent du pont salin vers la droite. demi-pile de gauche, pas de variation de pH. demi-pile de droite, H+ disparaît, donc le pH augmente. quand 0,01 mol Mg s'oxyde, il se forme 0,01 mol H2(aq) d'après l'équation bilan Mg(s) + 2H+ = Mg2+ +H2(aq) soit en volume 0,01 * 24 = 0,24 litre de dihydrogène
|
|||||
|