|
L'éthanoate d'éthyle (ou acétate d’éthyle) est, à 20°C, un
liquide de formule semi-développée :CH3 -COO-C2H5
Certains organismes de sécurité indiquent qu'il y aurait
incompatibilité entre l’éthanoate d’éthyle et la soude caustique. Ils
font en fait référence à la possibilité d'une réaction de
saponification dont on se propose d'étudier ici la cinétique chimique.
On dispose d’une part d’hydroxyde de sodium (ou soude), en solution
aqueuse, et d’autre part, d’éthanoate d’éthyle.
À l’instant de date t0 = 0 s, on met en présence
1,0 ×10 -2 mol de chacun des réactifs précédents. Le
mélange est placé dans un bain thermostaté qui maintient la température
à 20°C. On prélève, à différentes dates, un volume V = 2,0 mL du
mélange. Après avoir ajouté une grande quantité d’eau glacée, on dose
les ions hydroxyde restants par une solution d’acide chlorhydrique de
concentration CA = 5,0 ×10-3 mol.L-1
en présence de phénolphtaléine. Dans ces conditions, au moment du
virage de cet indicateur, seuls les ions hydroxyde ont réagi avec
l’acide chlorhydrique.
Donnée : zone de virage de la phénolphtaléine : incolore [8,2
; 10 ] rose
- Recopier la formule semi-développée de l’éthanoate
d’éthyle, puis entourer et nommer le groupe "caractéristique" (ou
fonctionnel) de cette molécule.
- Écrire l’équation-bilan de la réaction de saponification de
l'éthanoate d'éthyle.
- Nommer les produits obtenus.
- Donner les caractéristiques de cette réaction.
- Nommer la verrerie la plus adaptée pour prélever le volume
V = 2,0 mL du mélange.
- Pourquoi ajoute-t-on une grande quantité d’eau glacée avant de
réaliser le dosage des ions hydroxyde restants dans le volume V prélevé
?
- Écrire l’équation-bilan de la réaction qui sert de support au dosage.
- Quel est le changement de teinte observé lors du dosage ?
- Justifier que l’addition d’eau ne modifie pas le résultat du dosage.
- Détermination de la quantité nE d'éthanoate
d'éthyle restant dans un prélèvement de volume V = 2,0 mL. L'absence de
résolution de cette question n'empêche pas de traiter les questions 3
et 4.
- Établir l’expression donnant nE en fonction de la
concentration CA et du volume VA(E) de la
solution d’acide chlorhydrique versée à l’équivalence du dosage.
- Dans le prélèvement réalisé à l’instant de date t1 = 7
min, le volume d’acide chlorhydrique versé pour atteindre l’équivalence
du dosage est VA(E) = 6,0 mL. Calculer la valeur numérique
de la quantité nE d’éthanoate d’éthyle restant à cet instant.
- Les quantités nE d’éthanoate d’éthyle restant
aux différents instants de date t, dans un prélèvement de 2,0 mL, sont
données dans le tableau ci-dessous. On rappelle que 1 µmol = 10 -6 mol.
|
t min)
|
0
|
1
|
2
|
3
|
4
|
5
|
8
|
11
|
14
|
17
|
21
|
|
nE µmol
|
100
|
80
|
65
|
55
|
48
|
42
|
27
|
19
|
14
|
12
|
10
|
- Tracer la courbe donnant nE en fonction de la durée t.
- On définit la vitesse instantanée de disparition de
l’éthanoate d’éthyle à l’instant de date t par vE(t) = - dnE
/ dt
- Exposer succinctement la méthode permettant de déterminer la vitesse
instantanée de disparition de l’éthanoate d’éthyle à l’instant de date
t à partir de la courbe tracée.
- Comment cette vitesse évolue-t-elle au cours du temps ? Justifier
graphiquement sans calcul.
- Pourquoi subit-elle une telle évolution ?
Parmi les valeurs suivantes : 1 µmol.min-1 ;3 µmol.min-1
;7 µmol.min-1 ; 12 µmol.min-1, quelle est celle
qui correspond à la valeur de la vitesse de disparition de l’éthanoate
d’éthyle à l’instant de date t2 = 4 min ?
- Si on réalisait la même expérience à une température égale à 45°C,
tracer l’allure de la courbe donnant nE en fonction de la
durée t sur le même graphique que celui de la question 3. Justifier ce
tracé.
corrigé
CH3 -COO-C2H5
groupe ester en rouge
CH3 -COO-C2H5
+ HO- + Na+ -->CH3 -COO-
+ Na+ +C2H5 OH , lente, totale
produits : éthanoate de sodium et éthanol
pipette graduée + pipeteur
blocage cinétique de la réaction de saponification
H3O+ + HO- --> 2H2O
l'acide, solution titrante est dans la burette : dans le
bècher, l'indicateur coloré passe du rose à l'incolore au point
équivalent.
L'eau apporte très peu d'ion hydroxyde HO- et en
conséquence ne modifie pas le résultat du dosage.
A l'équivalence du dosage :
Qté de matière d'acide ajouté =CAVA(E) =
Qté de matière d'ion hydroxyde présents dans la prise de 2mL
nE = CAVA(E)
à t = 7 min : nE = 5 10-3 * 6 10-3
= 30 10-6 mol = 30 mmol.
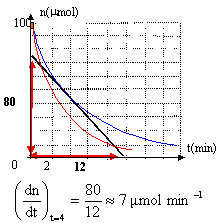
tracer la tangente à la courbe à la date t
déterminer ( en valeur absolue) le coefficient directeur de la
tangente.
Si la température augmente, la vitesse de la réaction
augmente.(courbe rouge)
A une date donnée, la tangente à la courbe est plus inclinée
sur l'horizontale.
|
