|
|
||||||
|
||||||
|
|
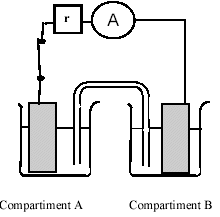
On réalise la pile schématisée ci-dessous en reliant par un pont salin deux compartiments contenant chacun une solution aqueusede sulfate de cuivre (II dans laquelle se trouve plongée une lame de cuivre. Les concentrations molaires en ions cuivre (II) dans les deux compartiments pourront prendre des valeurs égales ou différentes dans la suite de l'exercice.
corrigé Cu2+(aq) + 2 e- = Cu (s) réduction Compartiment A : l'augmentation progressive de la coloration de la solution est interprétée comme une augmentation de la concentration en ions Cu2+ (aq). La réaction à l'électrode A est : Cu (s)A= Cu2+(aq)A + 2 e- oxydation Compartiment B : l'apparition du dépôt de cuivre sur l'électrode est interprétée comme une transformation des ions cuivre (II) en cuivre solide soit : Cu2+(aq) B + 2 e- = Cu (s) B réduction Cu(s) A + Cu2+(aq) B= Cu(s) B + Cu2+(aq)A Qri = [Cu2+(aq)A]i / [Cu2+(aq) B]i = 0,01 / 1 = 0,01. (expérience n°1) et 1 ( expérience n°2) La deuxième expérience ne montre aucune évolution, on est dans un état d'équilibre On en déduit que la constante d'équilibre associée à cette équation de réaction est égale à 1,0 puisque Qr= K lorsque l'état d'équilibre est atteint. Si on connaît la valeur de K on peut en effet dire que comme Qr,i< K la réaction spontanée se fait dans le sens direct. Le cuivre
solide du compartiment A va se transformer en ion et inversement dans
le compartiment B
Cu (s)B= Cu2+(aq)B + 2 e- et Cu2+(aq)A + 2 e- = Cu (s)A La transformation globale serait alors modélisée par la réaction suivante qui se déroulerait selon le sens direct Cu(s)B + Cu2+(aq)A = Cu(s)A + Cu2+(aq)B [Cu2+(aq)A] >[Cu2+(aq)B] juste à la fin du processus. La concentration des ions dans le compartiment A a donc augmenté au cours du processus industriel, l'ingénieur doit demander de diluer la solution qu'il contient.
|
|||||
|