|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Données :
Afin de déterminer le pKa d'un couple acide base,noté AH / A-, on mesure le pH de solutions contenant les deux espèces conjuguées de ce couple. On utilisera une solution S1 contenant l'espèce A- de concentration molaire c1= 0,1 mol/L et une solution S2 contenant l'espèce AH, de concentration c2 = 0,1 mol/L. Avec un pHmètre on mesure le pH de plusieurs mélanges réalisés dans des béchers. V1 représente le volume de S1 et V2 celui de S2.
Identification du couple acide base :
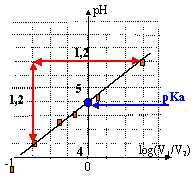
le coefficient directeur de la droite est voisin de +1 (fonction est croissante) ordonnée à l'origine : 4,8 fonction affine : pH = log(V1/V2) + 4,8 = log ( [A-] / [AH]) + 4,8 AH + H2O = A- + H3O+ Ka=[A-][H3O+]/[AH ] log Ka = log( [A-] / [AH]) + log [H3O+] - log [H3O+] = log( [A-] / [AH]) - log Ka pH = log( [A-] / [AH]) + pKa donc pKa proche de 4,8. parmi les couples donnés on élimine ceux dont le pka est trop différent de 4,8 soit : HCOOH / HCOO- et HClO / ClO- Quantité de matière (mol) d'acide = volume (L) * concentration (mol/L) n = 0,25*0,1 = 0,025 mol Quantité de matière (mol) d'acide = masse (g) / masse molaire (g/mol) masse molaire (g/mol) = 1,87 / 0,025 = 74,8 g/mol environ 74 g/mol donc on retient le couple H5C2-COOH / H5C2-COO- acide propanoïque / ion propanoate
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|