|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
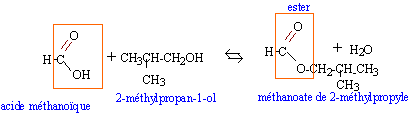
Le méthanoate de 2-méthylpropyle a une odeur qui évoque celle de la framboise. Sa formule s'écrit H-COO-CH2-CH(CH3)2. Molécule :
Réaction chimique permettant d'obtenir ce composé : Le méthanoate de 2-méthylpropyle peut être obtenu par une réaction lente entre deux réactifs A et B. Le réactif A est un acide carboxylique.
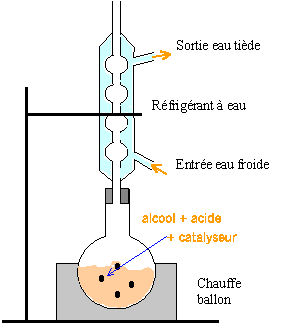
Montage permettant d'obtenir ce composé :
Cinétique de la réaction : rendement : A un instant t=0 on mélange 0,5 mol du réactif A et 0,5 mol du réactif B. On ajoute une petite quantité d' acide sulfurique et on maintient le milieu réactionnel à une température convenable. Le volume total du mélange réactionnel est V= 65 mL. On détermine toutes les 6 min la quantité n (mol) de méthanoate de 2-méthylpropyle formé.
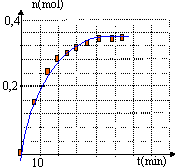
évite les pertes de matière et en travaillant à température modérée,on augmente la vitesse de la réaction.
la vitesse de la réaction est v = 1/V dx/dt = 1/V dn/dt V volume des réactifs (L) ; x avancement de la réaction (mol) ; n mol d'ester formé
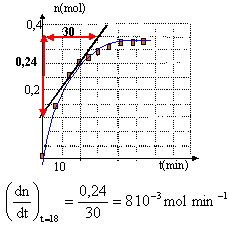
v (t= 18 min)= 1/ 0,065 * 8 10-3 = 0,123 mol L-1 min-1. à t supérieur à 60 min la tangente à la courbe est horizontale, la composition du mélange n'évolue plus : la vitesse de la réaction est nulle. rendement = Quantité de matière réelle d'ester divisée par la quantité de matière théorique rendement = 0,33 / 0,5 = 66%. en remplaçant l'acide méthanoïque par le chlorure de méthanoyle (H-COCl) ou l'anhydride méthanoïque ( H-CO)2O la réaction de formation de l'ester est totale. |
||||||||||||||||||||||||||||||||||||||||||||
|