|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
L'expérience suivante a pour but de déterminer le temps de demi-réaction t½ de la réaction entre l'acide chlorhydrique et le magnésium dont l'équation de la réaction est : Mg + 2H3O+ = H2 + Mg2+ + 2H2O. La transformation est supposée totale. protocole : Dans un ballon on introduit un volume L=10 mL d'une solution concentrée d'acide chlorhydrique (H3O+ ; Cl-) de concentration C= 8 mol/L. A l'instant initial on plonge un ruban de magnésium de longueur L= 5,1 cm. Très rapidement on ferme le ballon avec un bouchon percè qui permet de relier, par un tuyau, le contenu du ballon avec un manomètre. On note réguliérement la valeur de la pression indiquée sur le manomètre. Données : masse linéique du ruban de magnésium : l = 1g/m ;masse molaire du magnésium : 24,3 g/mol; volume du ballon vide : V0 = 100 mL ; Patm = 1,1 105 Pa ; T= 293 K ; R= 8,31 S.I étude théorique de la réaction :
Suivi de la pression : les résultats obtenus sont rassemblés dans le tableau suivant :
Influence de certains paramètres :
Mg : masse (g) / masse molaire (g/mol) masse = 1*0,051 = 0,051 g donc 0,051/24,3 = 2,1 10-3 mol = 2,1 mmol. ion oxonium : concentration (mol/L) fois volume (litre) = 8*0,01 = 0,08 mol = 80 mmol
PH2 = P -Patm x = (P -Patm)(V0-V) / (RT). ( volume en m3) x = 105 (P-1,1)(0,1-0,01) 10-3 / (8,31 *293) x = 3,7 10-3 (P-1,1).exprimé en mol
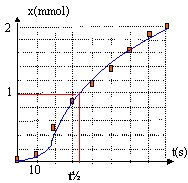
le temps de demi-réaction est la durée au bout de laquelle l'avancement x est égal à la moitié de la valeur de l'avancement final : le graphe indique environ t½= 34 s. x = 3,7 10-3 (P-1,1) donne P=1,1 +x /3,7 10-3 (pression en bar) Pmax = 1,1 + 2,1/3,7 = 1,67 bar P½ = 1,1 + 1,05 /3,7 = 1,38 bar au bout de t=80s, l'avancement est très proche de la valeur xmax (soit 2,1 mmol) : on peut considérer la réaction pratiquement terminée. La réaction s'effectue à la surface du magnésium solide : en augmentant la surface du solide ( en utilisant une poudre), on augmente la surface de contact entre les réactifs et en conséquence la vitesse de la réaction va augmenter. Alors t½ diminue et sera inférieur à la valeur précédente. La vitesse de la réaction augmente avec la température : alors t½ sera inférieur à 34 s si on travaille à une température plus élevée. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|