|
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
|
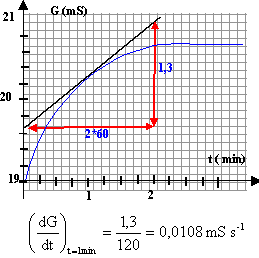
On s'intéresse à la réaction d'oxydoréduction entre les ions peroxodisulfate S2O82- et les ions iodures I- en solution aqueuse. couples oxydant / réducteur : S2O82- / SO42- et I2 / I-. Dans un bécher on introduit un volume V1 = 40 mL d'une solution aqueuse de peroxodisulfate de potassium ( 2K+ ; S2O82-) de concentration C1 = 0,1 mol/L et à l'instant t=0, on ajoute V2 = 60 mL d'une solution d'iodure de potassium ( K+ : I-) de concentration C2 = 0,15 mol/L. On obtient la courbe suivante : 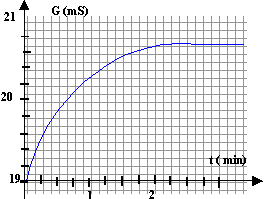
oxydation de l'ion iodure : 2I- -->2e- + I2. S2O82- +2I- -->2SO42-+ I2.
[S2O82-] = (4-x)/V [I- ] = (9-2x)/V [SO42-] = 2x/V [I2] = x/V [K+]=(40*0,1*2+60*0,15) / 100 = 0,17 mol/L G= k/V(l1(4-x)+l2(9-2x)+l32x+l40,017) G= k/V(4l1+9l2+0,017l4+ (2l3 -l1-2l2)x). vitesse volumique de la réaction : v = 1/ V dx/dt G= 1/V (A+Bx); dériver par rapport au temps cette expression dG/dt = B/V dx/dt soit v = 1/B dG/dt.
v (t=1 min) = 1/42*0,0108 = 2,57 10-4 mol L-1 s-1. si dG/dt = 0 (tangente horizontale) la vitesse de la réaction est nulle ; la réaction est alors terminée. lecture graphe : à partir de t = 2 min la réaction peut être considérée comme terminée.
|
|||||||||||||||||||||
|