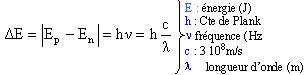|
|
||||||||||||||
|
||||||||||||||
|
|
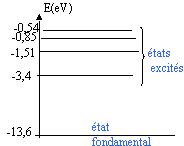
Données : célérité de la lumière dans le vide :3 108 m/s; constante de Plank : h=6,62 10-34 Js ; charge élémentaire : e = 1,6 10-19 C. On rappelle que l'énergie d'un atiome d'hydrogène est quantifiée et ne peut prendre que les valeurs suivantes : En = E0/ n² avec E0 = -13,6 eV et n = 1, 2, 3....
Les échanges d'énergies entre la lumière et la matière ne se font pas de manière continue mais par quantité élémentaire. Une transition atomique est le passage d'un état d'énergie à un autre. La fréquence d'un photon émis ou absorbé est reliée aux énergies En et Ep par la relation de Bohr :
Chaque raie d'unspectre est associée à l'émission ou l'absoption d'un photon lors d'une transition atomique.
transition n=5 à n=3 : l'énergie de l'atome diminue, un photon est émis DE= 1,511-0,544 = 0,967 eV ou 0,967*1,6 10-19 = 1,547 10-19 J longueur d'onde du photon émis : l = hc / DE l = 6,62 10-34*3 108 / 1,547 10-19 = 1,28 10-6 m ( domaine des U.V) les raies de la série de Balmer appartiennent au domaine du visible. Les raies de la
série de Paschen au domaine I.R, plus difficile à mettre en évidence au
début du XXè siècle.
état excité n=3 : E3 = -1,51 eV; état excité n=4 : E4 = -0,85 eV différence : 1,51-0,85 = 0,66 eV, donc le photon d'énergie 0,5 eV ne peut pas être absorbé par l'atome. à partir de l'état excité n=3 , il est possible d'ionisé l'atome en fournissant au minimum 1,51 eV. Un photon d'énergie 2eV ionise donc cet atome initialement à l'état excité n=3. L'énergie 2-1,51 = 0,49 eV est emportée par l'électron, sous forme d'énergie cinétique. |
|||||||||||||
|