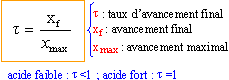|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Les mesures sont effectuées à 25°C. couples acide base : : acide éthanoïque / ion éthanoate pKa = 4,7 ; acide méthanoïque / ion m"thanoate pKa = 3,8 A partir de solution de même concentration C= 0,1 mol/L on prépare les solutions S1, S2, S3 et S4.
ou bien HCOOH + H2O = HCOO - + H3O+ recherche de l'avancement maximal :
xf = [H3O+] V = 10-pH V mmol
t = 10-pH V / (0,1 V ) = 10-pH / 0,1 = 10-pH+1 de l'ordre de 10-3. ce taux d'avancement final est très faible, les acides éthanoïque et méthanoïque ont très peu réagi avec l'eau. CH3-COO - + H2O = CH3-COOH + H3O+ ou bien HCOO - + H2O = HCOOH + H3O+
recherche de l'avancement maximal :
xf = [HO-] V = 10-14 V / [H3O+]= 10-14+pH V mmol
t = 10-14+pH V / (0,1 V ) = 10-14+pH / 0,1 = 10-13+pH de l'ordre de 10-9. ce taux d'avancement final est très faible, les ions éthanoate et méthanoate ont très peu réagi avec l'eau.
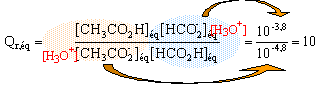
la constante de cet équilibre est égale à K=10. calcul du quotient de réaction initial : Qr,i = [HCOO-] i [H3C-COOH]i / ([HCOOH]i [H3C- COO-]i) mélange M : Qr,i = 1,6*2 / (0,2*0,2) = 80 Qr,i est supérieur à K, évolution telle que Qr ,i se rapproche de K, soit dans le sens indirect, de droite à gauche. mélange M' : Qr,i = 2*2,5 / (1*0,5) = 10 Qr,i = K on se trouve à l'équilibre.
xf sera noté X: Qr, f = (0,2+X)² /((1,6-X)(2-X) ) = 0,1 0,1(1,6-X)(2-X) = (0,2+X)² 0,32 +0,1X²-0,36X=X²+0,4X+0,04 0,9X²+0,76X-0,28 =0 résoudre. D= 0,76² + 4*0,9*0,28 =0,5776 + 1,008 = 1,5856 X = (-0,76 +1,26) / 1,8 = 0,28. d'où la composition final du mélange M à l'équilibre : HCOO- : 1,6-0,28 = 1,32 mmol ; H3C-COOH : 2-0,28 = 1,72 mmol ; HCOOH et H3C- COO- :0,2+0,28 = 0,48 mmol ; vérification : 1,32*1,72 / (0,48*0,48) = 9,86 voisin de 10. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||