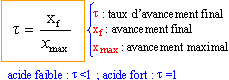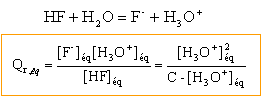|
On mesure la conductivité de différentes solutions
d'acide fluorhydrique HF :
|
solution
|
S1
|
S2
|
S3
|
|
concentration (mol/L)
|
0,01
|
10-3
|
10-4
|
|
conductivité s (S /m)
|
9 10-2
|
2,185 10-2
|
3,567 10-3
|
conductivité molaire ionique (S m² mol-1) : l H3O+ = 3,5 10-2 ; l éthanoate = 4,1 10-3.
- Ecrire la réaction de l'acide fluorhydrique avec l'eau.
- Déterminer la concentration des ions oxonium et des ions F-
dans ces solutions.
- Montrer que le quotient de réaction dans l'état d'équilibre
ne dépend pas de la concentration de la solution.
- Calculer le taux d'avancement de la réaction du fluorure
d'hydrogène avec l'eau pour chaque solution.
- Comment varie ce taux d'avancement avec la dilution ?
conductivité molaire ionique en Sm²/mol : l
H3O+ =3,5 10-2 ; l
F- = 5,54 10-3.
corrigé
HF + H2O = F- + H3O+
La concentration des ion fluorure est égale à la concentration
des ions oxonium : [F- ] =[H3O+]
les ions oxonium et fluorure contribuent à la conductivité de
la solution :
s = (l H3O+
+l F- ) [H3O+]=
( 3,5 +0,554) 10-2 [H3O+] soit [H3O+]
= s /4,05 10-2 = 24,67 s .
[H3O+] s'exprime en mol m-3 ;
xf = [H3O+] 10-3 = 24,67 10-3
s mol.
|
solution
|
S1
|
S2
|
S3
|
|
concentration C (mol / m3)
|
10
|
1
|
0,1
|
|
conductivité s (S /m)
|
9 10-2
|
2,185 10-2
|
3,567 10-3
|
|
[H3O+] = 24,67 s (mol / m3)
|
2,22
|
0,54
|
0,088
|
quotient de réaction : à
l'état d'équilibre
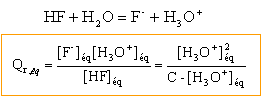
les concentrations s'expriment en
mol/L dans ce calcul.
|
solution
|
S1
|
S2
|
S3
|
|
concentration C (mol / L)
|
10-2
|
10-3
|
10-4
|
|
[H3O+] (mol / L)
|
2,22 10-3
|
5,4 10-4
|
8,8 10-5
|
|
C-[H3O+] (mol / m3)
|
7,78 10-3
|
4,6 10-4
|
1,2 10-5
|
|
Qr,éq
|
6,3 10-4
|
6,3 10-4
|
6,4 10-4
|
d'après la dernière ligne du tableau, le coefficient de
réaction dans l'état d'équilibre est constant, indépendant de la
concentration initiale : ce coefficient représente la constante
d'équilibre K associée à la réaction ci-dessus.
recherche de l'avancement maximal
:
|
HF
|
+ H2O
|
= F-
|
+ H3O+
|
|
initial
|
C mol
|
solvant
|
0
|
0
|
|
en cours
|
C -x
|
|
x
|
x
|
|
final
|
C-xmax =0
|
|
xmax = C mol
|
xmax = C mol
|
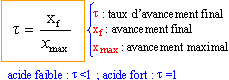
pour 1 L de solution :
|
solution
|
S1
|
S2
|
S3
|
|
concentration C (mol / L)
|
10-2
|
10-3
|
10-4
|
|
xf = [H3O+] * 1
(mol)
|
2,22 10-3
|
5,4 10-4
|
8,8 10-5
|
|
xmax = C *1 (mol )
|
10-2
|
10-3
|
10-4
|
|
t = xf / xmax
|
0,22
|
0,54
|
0,88
|
le taux d'avancement final augmente lorsque la concentration
en acide fluorhydrique diminue.
règle de Le Chatelier ou règle de
modération:
en ajoutant de l'eau (un réactif) on déplace l'équilibre dans
le sens "comsommation de l'eau", c'est à dire dissociation de l'acide
faible en ion oxonium et fluorure.
par dilution, un acide faible se rapproche du comportement
d'un acide fort.(t tend vers 1).
|