|
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
|
pH= - log [H3O+] ou bien [H3O+] = 10-pH = 10-2,9 = 1,26 10-3 mol/L. Quantité de matiére de chlorure d'hydrogéne dissout : 1,26 10-3 mol volume de gaz (L) = Qté de matière (mol) fois volume molaire (L/mol) = 1,26 10-3 *23,8 = 0,03L. nH+ = 1,26 10-3 mol/Lsoit environ100 fois plus petit que la concentration C1.
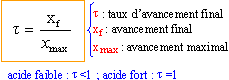
t = 1,26 10-3 / 0,1 = 1,26 10-2 (1,26%) facteur de dilution = C1 / C2 = 10 volume fiole jaugée / volume pipette = 10 prélever 10 mL de la solution mère de concentration C1 à la pipette graduée + pipeteur placer dans une fiole jaugée de 100 mL et compléter avec de l'eau distillée jusqu'au trait de jauge. pH= 3,4 donc n2 = xf = 10-3,4 = 4 10-4 mol/L xmax= 0,01 mol/L t = 4 10-4 / 0,01 = 4 10-2 (4%) règle de Le Chatelier ou règle de modération: en ajoutant de l'eau (un réactif) on déplace l'équilibre dans le sens "comsommation de l'eau", c'est à dire dissociation de l'acide faible en ion oxonium et éthanoate. par dilution, un acide faible se rapproche du comportement d'un acide fort. en diluant 10 fois la solution initiale d'acide chlorhydrique (acide fort), la concentration en ion oxonium est divisée par dix et le pH augmente d'une unité pH ( soit 2,9+1=3,9) |
|||||||||||||||||||||
|