|
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
L'ion dichromate Cr2O72- est l'oxydant du couple Cr2O72- / Cr3+. L'acide oxalique est le réducteur C2H2O4 du couple C2H2O4 / CO2. 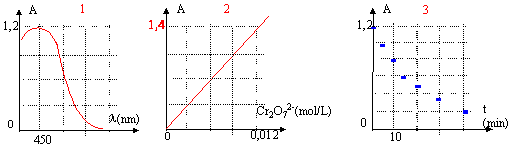
pour R-Cl : masse molaire = 92,6 g/mol ; densité d= 0,85.
oxydation du réducteur : 3 fois{ C2H2O4 --> 2 CO2 + 2H+ + 2e-} oxydo réduction : Cr2O72- + 14 H+ + 3 C2H2O4 --> 2Cr3+ + 6 CO2 + 6H++ 7H2O Cr2O72- + 8 H+ + 3 C2H2O4 --> 2Cr3+ + 6 CO2 + 7H2O On choisit la longueur d'onde correspondant au maximum d'absorption soit 450 nm. la solution absorbe dans le bleu ; la couleur complémentaire du bleu est le jaune, couleur de la solution contenant les ions dichromates. A partir de solutions étalons de concentrations connues, on trace la courbe d'étalonage pour l = 450 nm : à partir de la mesure de l'absorbance de la solution à titrer, on peut alors en déduire la concentration. L'absorbance est proportionnelle à la concentration en ion dichromate ( figure 2) ; déterminer le coefficient directeur de la droite : ce coefficient vaut : 1,4 / 0,012 = 116,7 L mol-1. A= 116,7 [Cr2O72- ] ou [Cr2O72- ] = 8,7 10-3 A le graphe [Cr2O72- ] = f(t) a même allure que le graphe A= f(t) car A et [Cr2O72- ] sont proportionnelles. Qté initiale des réactifs (mol) = concentration (mol/L) fois volume (L) dichromate : 0,02*0,01 = 2 10-4 mol = 0,2 mmol acide oxalique : 0,4 * 0,01 = 4 10-3 mol = 4 mmol
=3,4 mmol 0,2-xmax
=0 donne xmax = 0,2 mmol ; le réactif limitant est l'ion
dichromate.
volume de la solution : 20 mL [Cr2O72- ] (0,2-x) / 20 = 8,7 10-3 A ( résultat trouvé ci dessus) 0,2-x = 20*8,7 10-3 A = 0,174 A x = 0,2-0,174 A = 0,2 -A/6 mmol ou bien (0,2 -A/6) 10-3 mol
l'avancement final est égal à l'avancement maximal pour une réaction totale.
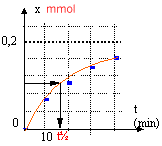
t½ voisin de 18 min. |
|||||||||||||||||||||||||||||||||||||||||||||||
|