|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
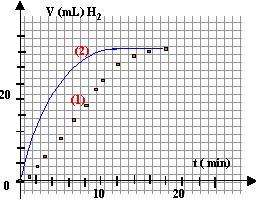
Dans un ballon de 250 mL, on verse 10mL de solution d'acide chlorhydrique de concentration 1 mol/L et 20 mL d'eau. On y ajoute rapidement 3 cm d'un ruban de magnésium bien décapé, tout en déclanchant un chronomètre. On ferme et on recueille le dihydrogène qui se dégage dans une éprouvette graduée, retour - menunée sur une cuve à eau. On relève toutes les minutes le volume V (mL) du gaz.
masse atomique molaire (g/mol) : Mg = 24,3 ; masse linéique du ruban de magnésium : 1 g /m. R= 8,318 S.I.
les ions oxonium, l'oxydant se réduisent : 2 H3O+ + 2e- --> H2 + 2H2O. Mg +2 H3O+ -->Mg2+ + H2 + 2H2O.
à partir de t = 16 min, le volume de H2 ne change plus : on peut alors considérer la réaction comme terminée. La réaction est lente, car on peut suivre l'évolution de la réaction ( mesurer le volume de gaz qui se dégage) pendant plusieurs minutes. à la fin de l'expérience le volume de H2 est V=31,6 mL = 31,6 10-3 L = 31,6 10-6 m3. Qté de matière de H2 (mol) n =PV / (RT) avec P= 101300 Pa ; T= 273+20 = 293 K n = 101300*31,6 10-6 / (8,318*293) =1,313 10-3 mol. Qté initial des réactifs : nMg = masse (g) / masse molaire = 0,03 / 24,3 = 1,234 10-3 mol n H+
= concentration (mol/L) * volume (L) = 1*0,01 = 0,01 mol.
= 10-2*1,234 = 7,53 mmol 1,234-xmax =0 donne xmax = 1,234 mmol ( valeur la plus petite à retenir) 10-2xmax =0 donne xmax = 5 mmol l'avancement maximum est 1,234 mmol : l'acide est en excès. la volume théorique de dihydrogène est à peu près égal au volume expérimental : la réaction est terminée à la date t >16 min. la concentration est un facteur cinétique : la concentration initiale de l'un des réactifs ( ion oxonium ) double alors la transformation sera plus rapide. (courbe 2 ci-dessus) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|