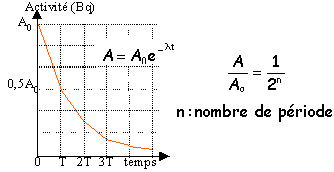|
|
||||||
|
||||||
|
|
datation au carbone 14 : Des fragments d'os et de charbon de bois ont été prélevés dans un site préhistorique. On mesure l'activité du carbone 14 des résidus d'os et de charbon, afin d'en déterminer l'âge. Le carbone 14 14C (Z=6) est produit constamment dans l'atmosphère suite au bombardement de l'azote 14N (Z=7) par les neutrons crées dans la haute atmosphère par les rayons cosmiques. Les plantes assimilent aussi bien l'isotope 12C que l'isotope 14C. Les abondances respectives de ces deux isotopes sont les mêmes dans le dioxyde de carbone de l'atmosphère et les êtres vivants. A la mort de ces derniers, il n'y a plus d'assimilation ; le carbone 14 radioactif se désintègre. Sa demi-vie ou période est égale à 5568 ans. L'activités du carbone 14 dans les résidus d'os donne 110 d'ésintégrations par heure et par gramme de carbone. L'échantillon de référence donne 13,6 désintégrations par minute et par gramme de carbone.
corrigé la demi-vie ou période radioactive, noté T ou t½ est la durée au bout de laquelle l'activité initiale a diminuée de moitié.
l'activité A0 à la date t=0 est de 13,6 désintégrations par minute et par gramme de carbone.l'activité à la date t est de 110 désintégrations par heure soit 110/60= 1,8 désintégrations par minute et par gramme de carbone. à t=T l'activité est : 13,6/2 = 6,8 à t= 2T l'activité est : 6,8/2 = 3,4 à t= 3T l'activité est 3,4/2 = 1,6 l'âge des résidus est voisin de 3 périodes soit 3*5568 = 16 700 ans. calcul plus précis : A= A0 exp -lt avec l = ln2 / t½ ln(A/ A0)= - ln2 t / t½ t = ln(A0/ A) t½/ ln2 soit 5568 /0,693 ln(A0/ A) = 8034 ln(A0/ A) t = 8034 ln (13,6
/1,8) = 16247
ans ( -14245
avant J-C)
|
|||||
|
pile atomique : Dans une pile atomique l'une des réactions est la suivante :
Masses des atomes 235 U : 234,993 32 u ; 94Sr : 93,894 46 u ; 140Xe : 139,891 94 u ; neutron : 1,008 66 u ; 1u = 1,66 10-27 kg. pouvoir calorifique du pétrole : 42 MJ/ kg ; 1 MeV = 1,6022 10-13 J ; c = 3 108 m/s ; N= 6,022 1023 mol-1 ;
235 +1 = 94 + 140 + x d'où x = 2. conservation de la charge : 92 = 38 + Z d'où Z= 54. perte de masse : masse des réactifs : 234,993 32+1,008 66 = 236,001 98 u masse des produits : 93,894 46+139,891 94+2*1,008 66 = 235,803 72 u | perte de masse | = 236,001 98-235,803 72 = 0,198 26 u soit en kg : 1,66 10-27 * 0,198 26 = 3,291 10-28 kg énergie correspondante : mc² = 3,291 10-28 (3 108)2 =2,962 10-11 J soit en MeV : 2,962 10-11 / 1,6 10-13 = 185,1 MeV. nombre d'atome d'uranium dans 5 g : 5 / 235 = 2,12 10-2 mol soit 2,12 10-2 * 6,02 1023 = 1,28 1022 atomes énergie libérée par la fission de 5 g d'uranium : 1,28 1022 *2,962 10-11 =3,79 1011 J. masse de pétroe libérant par combustion cette énergie : 3,79 1011 / 4,2 107 = 9 103 kg. |
||||||
|
La Terre est bombardée en permanence par des particules très énergétiques venant du cosmos. Ce rayonnement cosmique est composé notamment de protons très rapides. Les noyaux des atomes présents dans la haute atmosphère « explosent » littéralement sous le choc de ces protons très énergétiques et, parmi les fragments, on trouve des neutrons rapides. Ces neutrons rapides peuvent à leur tour réagir avec des noyaux d'azote de la haute atmosphère. Lors du choc, tout se passe comme si un neutron rapide éjectait un des protons d'un des noyaux d'azote et prenait sa place pour former un noyau Y1. Ce noyau Y1 est un isotope particulier du carbone, le carbone 14, qui est radioactif : en émettant un électron et une particule non observable, l'antineutrino, il se décompose en un noyau Y2. La période ou demi-vie du carbone 14 est 5 570 ans. Comme le rayonnement cosmique bombarde la Terre depuis longtemps, un équilibre s'établit entre la création et la décomposition du carbone 14 : il y a autant de production que de décomposition si bien que la teneur en carbone 14 de tous les organismes vivants reste identique au cours du temps. Ce carbone s.oxyde en dioxyde de carbone qui se mélange à celui de l.atmosphère, à celui dissous dans l.eau, etc. et sera métabolisé par les plantes et à travers elles par tous les organismes vivants. Dans chaque gramme de carbone de l'atmosphère ou des organismes vivants, les atomes de carbone sont en très grande majorité des atomes de carbone 12, mais il y a 6,8.1010 atomes de carbone 14. D.après I. Berkès « La physique du quotidien » On donne, pour différents noyaux : H : Z = 1 ; He : Z = 2 ; C : Z = 6 ; N : Z = 7 ; O : Z = 8.
corrigé Le noyau d'hydrogène contient 1 nucléon au total, dont 1 proton. Il est donc constitué uniquement d.un proton. Lors d'une réaction nucléaire, il y conservation du nombre de nucléons A et du nombre de charge Z. Y1 contient 6 protons, c'est donc un noyau de carbone, composé de 6 protons et de 14 - 6 = 8 neutrons. 146C-->-10e + 147Y2. Radioactivité ß-. Y2 contient 7 protons, c'est donc un noyau d'azote. Le temps de demi-vie est le temps au bout duquel la moitié des noyaux présents initialement dans l'échantillon ont disparu. l = ln2 / t½ l = [ln2] / (5570 × 3600 × 24 × 365) = 3,94 × 10-12 s-1. -DN = 3,94 × 10-12 × 60 × 6,8 × 1010 = 16 désintégrations./min/g car N est constant dans un organisme vivant. soit = 16 / 60 = 0,27 désintégrations./seconde/g = 0,27 Bq/g Les organismes vivants perdent quotidiennement des atomes de carbone 14 par sécrétion respiration, déjections... et du fait de sa désintégration spontanée. Ils assimilent arallèlement du carbone notamment dans leur alimentation. Ce carbone est composé entre autres de carbone 14 qui entretient les réserves de l'organisme vivant. Ainsi, dans leur organisme, la proportion de carbone14comparée à celle de carbone 12 reste celle de l'environnement dans lequel ils vivent. Quand l.organisme meurt, il n.entretient plus ses réserves en carbone 14 qui s'amoindrissent donc peu à peu. -DN/Dt =l. N Donc N = -1 /l. DN/Dt Or .DN/Dt = 10 / 60 dés. /s.g Donc N = 10 / (60 × 3,94 × 10-12 ) = 4,2 × 1010 atomes N = N0 exp (-lt) donc t = -1/l ×ln(N/N0) t= -1/4 10-12× ln (4,2 × 1010 / 6,8 × 1010) t= 1,2 × 1011 s = 3,8 ×103 ans.
|
||||||
|