|
Pondichéry 04/ 02 |
||||||
|
||||||
|
|
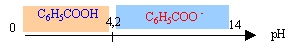
Données : La solubilité s dans l'eau d'une substance à la température t est la masse maximale de substance que l'on peut dissoudre dans un litre d'eau à cette température t. Elle s'exprime en g /L. acide benzoïque : C6H5COOH solide blanc aspect soyeux ; monoacide faible peu soluble dans l'eau ( 3g/L à 25 °C) ; masse molaire : 122 g/mol ; conservateur alimentaire utilisé dans les boissons rafraichissantes sans alcool ( code E 210). benzoate de sodium : C6H5COONa solide ionique blanc ; masse molaire 144 g/ mol ; solubilité dans l'eau à 25 °C : 650 g/L valeur du pKa du couple acide benzoïque / ion benzoate : pKa = 4,2. zone de virage du rouge de crésol [7,2 ; 8,8] ; jaune en milieu acide; rouge en milieu basique. partie 1 :
partie 2 :
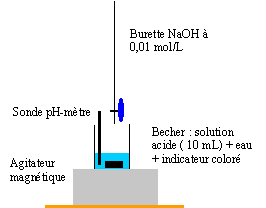
partie 3 : On se propose de déterminer la solubilité de l'acide benzoïque à 25 °C. On pèse environ 0,4 g d'acide benzoïque et on l'introduit dans un bécher contenant environ 100 mL d'eau distillée. Après quelques minutes d'agitation, de petits grains restent en suspension. Une filtration permet d'obtenir la solution saturée en acide benzoïque de concentration CA. On introduit dans un erlenmeyer VA = 10 mL de cette solution ; on y ajoute quelques gouttes de rouge de crésol et on dose par une solution d'hydroxyde de sodium (soude) de concentration CB= 0,01 mol/L. Le rouge de crésol change de couleur pour un volume de soude ajouté de 19,6 mL.
constante d'acidité : Ka = [C6H5COO-][ H3O+ ] / [C6H5COOH] à pH inférieur à pKa la forme acide AH prédomine; à pH supérieur à pKa la forme base conjuguée A- prédomine; à pH=pKa les forme acide et base conjuguée sont en quantités égales.
pH = pKa + log [C6H5COO-] / [C6H5COOH] log [C6H5COO-] / [C6H5COOH] = pH-pKa = 3,5-4,2 = -0,7 log [C6H5COOH] / [C6H5COO-] = 0,7 [C6H5COOH]
/ [C6H5COO-] = 10 0,7 =5.
Prélever 20 mL de la solution mère à l'aide d'une pipette graduée + pipeteur Placer dans une fiole jaugée de 50 mL Compléter avec de
l'eau distilée jusqu'au trait de jauge.
K = [C6H5COOH] / ([H3O+ ][C6H5COO-] = 1 / Ka = 104,2 = 1,6 104. cette constante est grande : la réaction est donc totale. il se forme de l'acide benzoïque : Qté de matière initiale de benzoate de sodium : 0,2*0,01 = 2 10-3 mol il se forme donc 2 10-3 mol d'acide benzoïque soit 0,002*122 =0,244 g dans environ 10 mL de solution c'est à dire 24,4 g dans 1 L, valeur bien supérieure à la solubilité de l'acide benzoïque à 25 °C : ce dernier précipite .
cette valeur est supérieure à la solubilité de l'acide benzoïque à 25°C : d'où un précipité. dosage :
C6H5COOH + HO- --> C6H5COO- +H2O Le rouge de crésol initialement jaune devient rouge. A l'équivalence les quantités de matière d'ion hydroxyde ajouté et d'acide benzoïque sont égales. Avant l'équivalence l'acide benzoïque est en excès ; après l'équivalence l'ion hydroxyde est en excès. à l'équivalence CaVa = CbVb Ca = 0,01* 19,6 /10 = 1,96 10-2 mol/L solubilité : 0,0196 * 122 = 2,39 g/L.
|
|||||
| |
||||||
|