|
Amérique du Nord 06/01 |
|||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||
|
|
l'arôme naturel : La menthone est un des constituants de certaines espèces de menthe dont la menthe poivrée. L'extraction de l'huile essentielle de la menthe poivrée se fait en utilisant le dispositif expérimental ci-dessous : 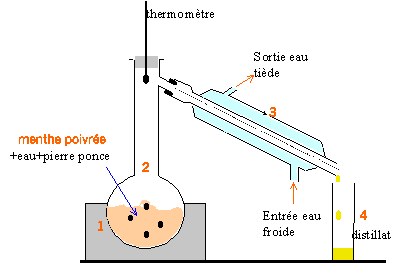
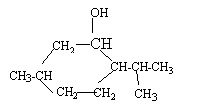
arôme artificiel : La menthone ne représente que 10% de l'huile essentielle mais on peut préparer cet arôme par oxydation ménagée du menthol, lui même obtenu par extraction de l'espèce végétale (50% de l'huile essentielle)
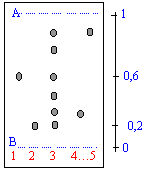
1 : chauffe ballon ; 2 : ballon ; 3 : réfrigérant ; 4 : éprouvette graduée. Le trait A matérialise le front du solvant. Le trait B matérialise la ligne des dépôts. le menthol, la menthone, l'eucalyptol et le menthofuranne sont contenus dans l'huile essentielle Le rapport
frontal de la menthone est égal à la distance parcourue par la menthone
divisée par la distance parcourue par le solvant ou éluant soit 0,6
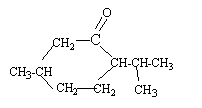
La menthone posséde une fonction cétone (>C=O) : elle est liquide à 20°C. le chauffage à
reflux permet d'accélérer la réaction en travaillant à température
moyenne tout en évitant les pertes de matière.
ou bien 0,08 -2 xmax =0 soit xmax =0,04 mol on peut espérer
obtenir 0,1*154 = 15,4
g de menthone.
dans une ampoule à décanter les deux liquides non miscibles se séparent en fonction de leur densité par rapport à l'eau. Le plus dense (ici l'eau ) occupe la partie inférieure. le moins dense ( le cyclohexane) occupe la partie supérieure. le procédé de séparation de la menthone et du cyclohexane est judicieux car ces deux liquides ont des températures d'ébullition nettement différentes : le cyclohexane, le plus volatil distille et la menthone reste dans le ballon. rendement = Qté expérimentale / Qté théorique = 11,2 / 15,4 = 0,72.
|
||||||||||||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||||||||||||
|