|
acide faible ; acide fort dosés par la soude |
||||||
|
||||||
|
|
on dissout 3,0.10-2g.d'acide acétique (CH3COOH) dans un 1/2 verre litre d'eau. Le pH de la solution est égal à 4,05.
données : pKa(CH3COOH / CH3COO- )= 4,8 corrigé |
|||||
|
produit ionique de l'eau : [HO-] = 10-14 / 10-4,05 = 1,12 10-10 mol/L acide acétique noté AH : masse molaire 60g/mol masse / masse molaire : 0,03/60 = 5 10-4 mol = 0,5 mmol puis diviser par le volume du verre d'eau en litre : soit C la concentration de l'acide conservation élément carbone : [AH]+[A-]= C la solution est électriquement neutre avec HO- négligeable [H3O+] = [A-] écrire la définition de la constante d'acidité Ka = [A-][H3O+] / [AH] [AH] = [A-][H3O+]
/ Ka = (8,9 10-5)² / 10-4,8 = 5 10-4 mol/L.
soude : 2,5*0,1= 0,25 mmol en défaut (il y a 0,5 mmol d'acide initialement) le dosage acide faible-base forte est arrêté à la demi équivalence donc pH=pKa = 4,8 , solution tampon Na+ : 0,25 mmol ; A- : 0,25 mmol ; AH : 0,25 mmol
|
||||||
|
On dose 2 solutions acides A1H et A2H (l'une est une solution d'acide fort, l'autre une solution d'acide faible) par la même solution de soude. Le volume des 2 solutions acides est égal à 25 mL. La concentration de la solution de soude est égale à 1mol/L. Les volumes de soude à l'équivalences sont respectivement V1 = 10 mL et V2 = 14 mL. 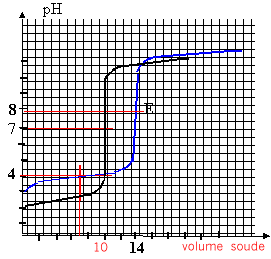
AH + HO- --> A- + H2O à l'équivalence CaVa = CbVb pour l'acide n°1 : 25 C1 = 10*1 d'où C1 = 0,4 mol/L pour l'acide n°2 : 25 C2 = 14*1 d'où C2 = 0,56 mol/L la zone de virage de l'indicateur coloré doit contenir le pH à l'équivalence. dosage acide fort base forte : (A1H ) pH=7 à l'équivalence le graphe a un seul point d'inflexion ; indicateur coloré BBT dosage acide faible base forte : pH équi >7 car la solution contient la base faible A2- à l'équivalence le graphe a 2 points d'inflexion ( équivalence et à la demi équivalence) le pH à la demi équivalence est égal au pKa. soit 3,9 dans ce cas ( acide méthanoïque) indicateur coloré : phénolphtaléine à la demi équivalence du dosage acide faible-base forte, on a une solution tampon : les quantités de matière d'acide et de base conjuguée sont identiques. on peut également préparer une solution tampon en mélangeant de 10 mL de méthanoate de sodium à 0,1 mol/L et 10 mL d'acide méthanoïque à 0,1 mol/L
|
||||||
|
On dose 2 solutions basiques B3- et B4- (l'une est une solution de base forte, l'autre une solution de base faible) par la même solution d'acide fort (HCL). Le volume des 2 solutions basiques est égal à 35 mL. La concentration de la solution de HCL est égale à 1mol/L. On obtient les 2 courbes çi-dessous. 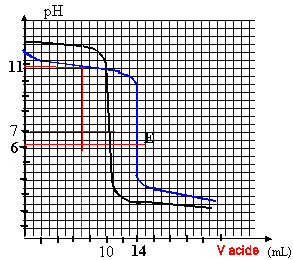
à l'équivalence CaVa = CbVb pour la base n°3 : 35 C3 = 10*1 d'où C3 = 0,286 mol/L pour la base n°4 : 35 C2 = 14*1 d'où C4 = 0,4 mol/L la zone de virage de l'indicateur coloré doit contenir le pH à l'équivalence. dosage acide fort base forte : (B3- ) pH=7 à l'équivalence le graphe a un seul point d'inflexion ; indicateur coloré BBT dosage acide fort base faible : pH équi <7 car la solution contient l'acide faible B4H à l'équivalence le graphe a 2 points d'inflexion ( équivalence et à la demi équivalence) le pH à la demi équivalence est égal au pKa, soit 10,5 dans ce cas indicateur coloré : hélianthine à la demi équivalence du dosage acide fort-base faible B4-, on a une solution tampon : les quantités de matière d'acide et de base conjuguée sont identiques et le pH est égal au pKa du couple B4H / B4- soit 10,5. dosage base forte - acide fort avec arrêt à 7 mL d'acide versé : pH=12 d'où [H3O+] =10-12 mol/L produit ionique de l'eau :[H3O+] [HO-] = 10-14 à 25°C d'où [HO-] = 0,01 mol/L ion chlorure apporté par l'acide : [Cl-] = 7*1 / (35+7) =0,1667 mol/L base forte [B3-] = ( 35*0,286 - 7*1) / (35+7) = 0,0714 mol/L cation A+ accompagnant B3-en solution : 35*0,286 / 42 = 0,238 mol/L acide [BH] = 7*1/ 42 = 0,1667 mol/L
|
||||||
|