|
Asie 06/01 |
|||||||||||||||||
|
|||||||||||||||||
|
|
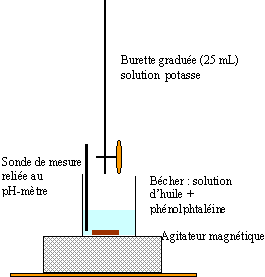
données : masse molaire g/mol C=12 ; O=16 ; H=1 ; K=39 document : Une huile de table est essentiellement constituée d'un mélange de triesters. Cependant une quantité faible et variable d'acides gras libres peuvent être présents. Le protocole proposé nous renseigne sur cette quantité d'acide gras libre.
protocole : Dans un erlenmeyer de 250 mL, on mesure précisément une masse m =10 g d'huile puis on ajoute 40 mL d'éthanol, 40 mL d'ether éthylique permettant la dissolution de l'huile et quelques gouttes de phénolphtaléine. On agite pour homogénéiser le mélange. On réalise le dosage du mélange contenu dans l'erlenmeyer par une solution S de potasse alcoolique ( hydroxyde de potassium en solution dans l'éthanol) de concentration 0,05 mol/L. On considère que l'hydroxyde de potassium dans l'éthanol a le même comportement que dans l'eau. Le virage de l'indicateur est obtenu pour un volume d'hydroxyde de potassium versé de 6,2 mL. Questions :
L'action du glycérol sur un acide gras donne un triester ou triglycéride. dosage : La phénolphtaléine joue le rôle d'indicateur coloré.
la saponification d'un ester par la potasse ou la soude est très lente à température ambiante. La réaction d'une base forte sur un acide faible est rapide. en conséquence la saponification ne fausse pas le dosage acide base. dosage acide faible base forte : R-CO2H + HO- ---> RCO2- + H2O réaction rapide, totale, quantitative et exothermique la constante de cette réaction est grande, supérieure à 5 000. A l'équivalence les quantités de matière d'acide et de base sont dans les proportions stoéchiométriques. CaVa = CbVb (monobase et monoacide) Avant l'équivalence l'un des réactifs est en excès ( acide dans ce cas). Après l'équivalence l'autre réactif est en excès (potasse). Qté de matière de potasse : 5 10-2 * 6,2 10-3 = 3,1 10-4 mol soit 3,1 10-4 *56 = 17,36 10-3 g = 17,36 mg de potasse pour 10 g d'huile. 1,736 mg de potasse pour 1 g d'huile. |
||||||||||||||||
|
|
|||||||||||||||||
|
|||||||||||||||||