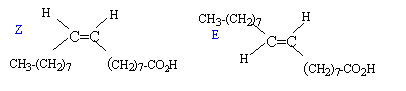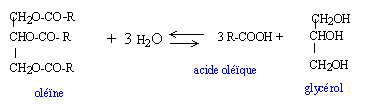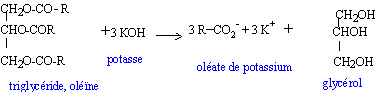|
Polynésie 06/01 |
||||||
|
||||||
|
|
données : masse molaire g/mol potasse 56 ; acide oléïque : 282 huile d'olive : Un corps gras est un triester du glycérol (ou propane-1,2,3-triol) et d'un acide gras. Un acide gras est un acide carboxylique à chaîne linéaire qui contient généralement un nombre pair d'atomes de carbone, comme par exemple l'acide oléïque : CH3-(CH2)7-CH=CH-(CH2)7-COOH noté R-COOH par la suite. On considérera que l'huile d'olive est constituée essentiellement d'oléïne , triester du glycérol et de l'acide oléïque.
dégradation de l'huile d'olive : IAu cours du temps et au contact de l'air humide un corps gras
s'hydrolyse lentement pour donner du glycérol et l'acide gras
correspondant. Un corps gras contient donc toujours en plus ou moins
grande quantité de l'acide libre. Déterminer l'indice d'acide gras d'une huile d'olive : Pour qu'une huile soit consommable on admet que la teneur en acide libre ne doit pas dépasser 1 % en masse. Pour chiffrer cette teneur on utilise l'indice d'acide. l'indice d'acide est la masse d'hydroxyde de potassium ou potasse KOH, exprimée en milligrammes, nécessaire au dosage de l'acide libre contenu dans un gramme de corps gras. Pour déterminer cet indice on effectue les opérations suivantes : Dans un erlenmeyer on verse successivement 20 mL d'éthanol à 95% (solvant), 0,5 g d'huile d'olive et deux gouttes de phénolphtaléine. On ajoute alors progressivement une solution alcoolique de potasse de concentration Cb = 0,01 mol/L. Bien que l'on utilise des solvants non aqueux, on considérera que les formules de la potasse et de l'acide sont les mêmes que dans l'eau. Une coloration rose persistante apparaît pour un volume ajouté de 12 mL.
réaction parasite : Au cours de la détermination de l'indice d'acide de cette
huile une autre réaction est susceptible de se produire entre l'oléïne
et la potasse. Cependant on considérera que cette réaction ne perturbe
pas les résultats du dosage.
l'acide oléique présente une isomérie de type Z E : diastéréoisomérie
hydrolyse de l'oléïne :
dosage acide faible base forte : R-CO2H + HO- ---> RCO2- + H2O réaction rapide, totale, quantitative et exothermique la constante de cette réaction est grande, supérieure à 5 000. A l'équivalence les quantités de matière d'acide et de base sont dans les proportions stoéchiométriques. Avant l'équivalence l'un des réactifs est en excès. Après l'équivalence l'autre réactif est en excès. Qté de matière de potasse : 10-2 * 12 10-3 = 1,2 10-4 mol soit 1,2 10-4 *56 = 6,72 10-3 g = 6,72 mg de potasse pour 0,5 g d'huile. 13,44 mg de
potasse pour 1 g d'huile.
1,2 10-4 * 282 = 3,34 10-2 g d'acide oléïque libre dans 0,5 g d'huile 3,34 10-2 /0,5 *100 = 6,7 %. valeur supérieure à 1%, l'huile n'est pas consommable. saponification du triester : lente, totale
|
|||||
|
|
||||||
|