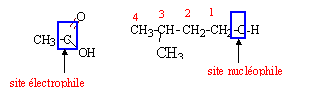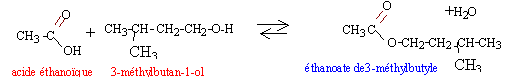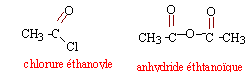|
Antilles 06/01 |
||||||
|
||||||
|
|
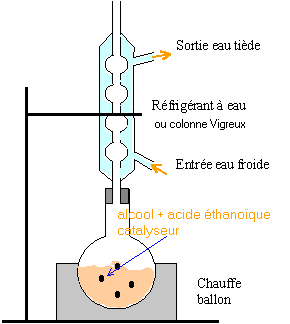
dispositif expérimental : Les esters qui ont souvent une odeur fruitée sont fréquement utilisés dans l'industrie alimentaire. En parfumerie, ils ne sont utilisés que pour les parfums bon marché à cause du groupe ester peu stable vis à vis de la transpiration. Ce groupe se dégrade en donnant l'acide carboxylique précurseur de l'ester, acide d'odeur souvent désagréable. Considérons la préparation d'un ester très fruité, mais aussi constituant actif de la phéromone d'alarme de l'abeille : l'éthanoate de 3-méthylbutyle. protocol expérimental : Introduire 10,6 mL ( 100 mmol) de 3-méthylbutan-1-ol, 23 mL ( 400 mmol) d'acide éthanoïque et un barreau aimanté dans un ballon. Ajouter 2 mL d'acide sulfurique concentré, mettre l'agitation en marche et chauffer à reflux pendant 2 heures. Après traitements( refroidissement, décantation, élimination de la phase aqueuse) on récupère 13 mL d'ester. données : masse volumique de l'ester : 0,87 g/mL masse atomique molaire (g/mol) :H=1 ; C=12 ; O=16. Questions :
l'atome de carbone de la fonction acide carboxylique est déficitaire en électrons l'atome d'oxygène de la fonction alcool primaire est riche en électrons.
l'esterification
est lente, athermique, limitée par l'hydrolyse de l'ester
accélére la réaction ( en travaillant à température plus élevée) et évite les pertes de matière
en utilisant un réactif (l'acide éthanoïque) en excès on déplace l'équilibre vers la formation de l'ester (loi de modération). l'acide sulfurique joue le rôle de catalyseur. la température est un facteur cinétique : la vitesse de la réaction sera augmentée. Le réfrigérant condense les vapeurs : celles ci retombent dans le ballon et il n'y a pas de pertes de matière lors du chauffage. rendement : masse réelle d'ester obtenue / masse théorique d'ester *100 % à partir de 0,1 mol d'alcool on peut théoriquement obtenir 0,1 mol d'ester masse molaire de l'ester : C7 H14O2 : 7*12+14+2*16 = 130 g/mol soit : 0,1 * 130 = 13 g d'ester masse expérimentale : 13*0,87 = 11,31 g rendement : 11,31 / 13 *100 = 87 %. En utilisant le chlorure d'éthanoyle ou l'anhydride éthanoïque à la place de l'acide éthanoïque, on obtient un rendement proche de 100%.
|
|||||
|
|
||||||
|