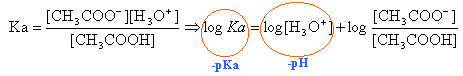|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
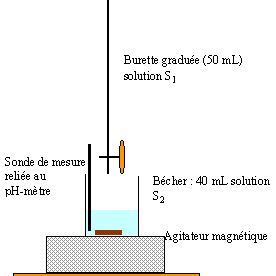
Determination du pKa du couple acide éthanoique/ion éthanoate : On mesure le pH de solutions contenant ces deux espèces chimiques. On donne : - une solution S1 d'éthanoate de sodium, de concentration molaire volumique C1 = 0,1 mol.L-1, - une solution S2 d'acide éthanoique, de concentration molaire volumique C2 = 0,1 mol.L-1 On dispose du matériel suivant : verrerie : 1 bécher de 50 mL, 1 bécher de 100 mL, 1 pipette jaugée de 10 mL, 1 pipette jaugée de 20 mL ,1 burette de 50 mL, graduée en mL, un pH-mètre préalablement étalonné, un agitateur magnétique, un support de burette. 1)Frabication des mélanges : Le tableau 1 ci-dessous indique quels
mélanges on devra préparer :
2)Les mesures du pH : On admettra que les proportions de S1 et S2 sont telles que pour chaque mélange : [CH3COO -] / [CH3COOH] = V1/V2. Avec le pH-mètre on effectue les mesures
de pH pour les mélanges du tableau 1 et pour quatre autres mélanges
supplémentaires M6 , M7 , M8, M9.
Compléter le tableau 2 :
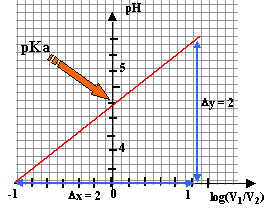
- Tracer la courbe représentant : pH = f( log (V1/V2) ) , soit pH = f ( log [CH3COO -] / [CH3COOH] ) échelles : en abscisses : 10 cm pour 1 ; en ordonnées : 2 cm pour 1 3) Exploitation des résultats : - Quelle est l'allure de la courbe tracée ? - En déduire la relation entre pH et log [CH3COO -] / [CH3COOH] - Ecrire l'équation-bilan représentant la réaction de l'acide éthanoique avec l'eau - Donner la relation définissant la constante d'acidité Ka du couple CH3COOH / CH3COO - . - En déduire la relation entre le pH d'une solution contenant à la fois l'acide éthanoique et des ions éthanoate et le pKa du couple. - Déduire des questions précédentes la valeur approchée du pka du couple CH3COOH / CH3COO -que ces mesures permettent d'obtenir.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
la courbe est une droite : - dont le coefficient directeur est égal à 1 - dont l'ordonnée à l'origine est égale au pKa du couple acide / base étudié soit pKa voisin de 4,6.
équation de la droite pH = pKa + log ([CH3COO-]/[CH3COOH]) CH3COOH + H2O équilibre avec CH3COO- + H3O+.
on retrouve l'équation de la droite. calcul du pKa à partir du tableau :
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|