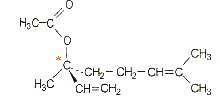|
bac 09/01
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|
On se propose d'illustrer dans cet exercice quelques exemples d'utilisation d'acides organiques et de leurs dérivés. L'exercice comporte deux parties indépendantes. Les parfums et les acides : Les esters sont des dérivés d'acide d'odeur souvent agréable, comme par exemple 1'éthanoate (ou acétate) de butyle (noté A) présent dans de nombreux fruits, et l'éthanoate (ou acétate) de linalyle (noté B) présent dans la lavande. 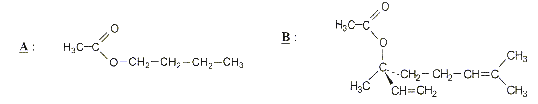
répondre vrai ou faux :
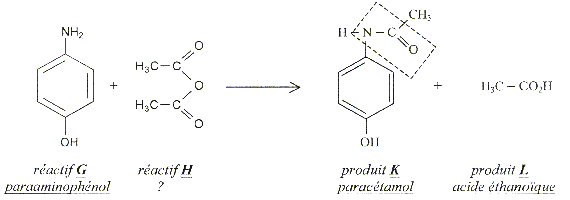
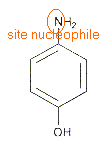
Les médicaments : Les dérivés des acides entrent dans la fabrication de nombreux médicaments comme par exemple le paracétamol qui est préparé selon la réaction d'équation - bilan :
|
||||||||||||||||||
|
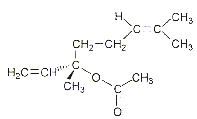
de l'acide éthanoïque (ou acétique) et du butan-1-ol. cette réaction est lente limitée par l'hydrolyse de l'ester Un catalyseur permet d'atteindre plus rapidement l'équilibre sans en changer la composition A ne posséde pas de liaison double C=C, donc pas d'isomérie ZE A ne posséde pas de carbone asymétrique, donc pas d'isomères optiques (énantiomères) A posséde plusieurs isomères de conformations ( par simple rotation autour d'une liaison simple carbone carbone) A posséde des isomères, par exemple : CH3-COO- CH2 -CH(CH3)2 saponification de l'ester par la soude CH3-COO- (CH2)3-CH3 + NaOH --> CH3-COO- + Na+ + HO-CH2-CH2-CH2-CH3 B posséde un atome de carbone asymétrique, est chirale, n'est pas superposable à son image dans un miroir.
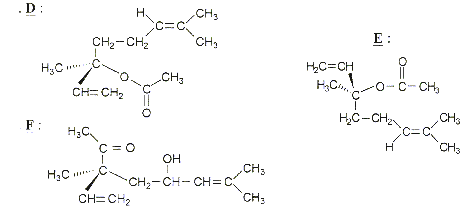
D et C: isomères de configuration (énantiomères) D est l'image de E dans un miroir plan horizontal ; donc E est identique à C Quant à F elle diffère de C, il existe une fonction cétone à la place de la fonction ester. il n'y a pas d'isomèrie Z E car le carbone terminal doublement lié possède deux groupes méthyl -CH3 identiques un catalyseur comme l'acide sulfurique catalyse estérification et hydrolyse un catalyseur permet d'atteindre plus rapidement l'équilibre, sans en changer la composition.
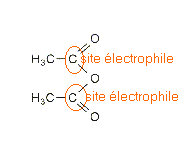
médicaments : H est l'anhydride éthanoïque le groupe encadré est le groupe amide.
H est en excès. masse théorique de paracétamol : 1,8 10-3 *151 = 0,271 g rendement : masse réelle *100 / masse théorique mK *100 *MG/ ( mG*MK) = 54,1%
|
|||||||||||||||||||
|