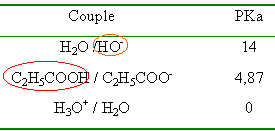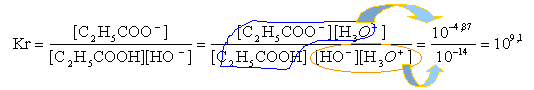|
bac Amérique du Nord 06 /01.
|
||||||
|
||||||
|
|
L'acide propanoïque C2H5-COOH appartient au couple acide base: acide propanoïque/ion propanoate pKa = 4,87. L'étiquette d'un flacon contenant une solution d'acide propanoïque propose deux valeurs de concentration molaire C1 = 0,028 mol/L et C2 = 0,03 mol/L.
|
|||||
|
or ici log 0,03 =1,52 ne correspond pas au pH mesuré; celui ci est bien supérieur. Donc l'acide propanoïque n'est pas un acide fort. D'autre part le pKa d'un acide fort vaut pKa=0 , or ici on nous propose pKa = 4,87. C2H5-COOH + H2O en équilibre avec C2H5-COO- + H3O+.
réaction naturelle entre l'acide le plus fort et la base la plus forte (entourés ci dessus ) C2H5COOH + HO- -->C2H5COO- + H2O totale, exothermique
la constante de réaction est grande; la réaction est totale. à l'équivalence les quantités de matière d'acide et de base sont stoéchiométriques. Avant l'équivalence l'acide est en excés, après l'équivalence la base est en excès.
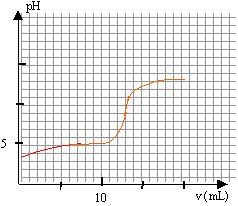
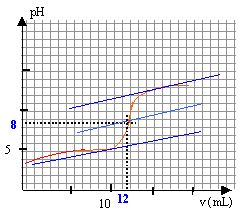
CbVb = CaVa Ca= 0,05*12/20=0,03 mol/L le pH à la demi équivalence est égal au pKa du couple acide base acide propanoïque / ion propanoate. on lit sur le graphique pour v= 6mL , pH voisin de 5.
|
||||||
|