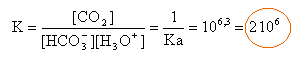|
bac Antilles 09 /2000.
|
||||||
|
||||||
|
|
protocole expérimental : Le bicarbonate de soude "officinal" utilisé en cas d'excès d'acidité gastrique est l'hydrogénocarbonate de sodium NaHCO3. On se propose de vérifier le degré de pureté d'un échantillon. La manipulation comporte deux étapes: - réaction d'une masse donnée d'échantillon avec une solution d'acide chlorhydrique en excès - dosage de l'excès d'acide chlorhydrique par une solution de soude( hydroxyde de sodium) CO2, H2O / HCO3- : pKa =6,4 ; HCO3- /CO32- : pKa =10,3 ; masse molaire NaHCO3 = 84 g/mol. 1ère étape : - peser dans un erlenmeyer 1 g de bicarbonate de soude. - ajouter 25 mL d'acide chlorhydrique de concentration Ca= 1 mol/L. On observe un dégagement gazeux. Le bilan de cette réaction est : HCO3-+ H3O+ -->CO2 + 2H2O(1) - Quand le dégagement gazeux a cessé, rincer la paroi intérieure de l'erlenmeyer avec un jet de pissette d'eau distillée. -Ajouter quelques grains de pierre ponce. - adapter un réfrigérant à air (bouchon muni d'un long tube de verre). -chauffer le mélange 3 à 4 min puis refroidir l'erlenmeyer sous l'eau du robinet. - rincer à nouveau la paroi intérieure de l'erlenmeyer. 2 ème étape : - Placer le contenu de l'erlenmeyer dans une fiole jaugée de 200 mL puis compléter avec de l'eau distillée. On obtient une solution S2. - prélever 20 mL de cette solution S2. - Doser ces 20 mL avec une solution de soude de concentration 0,1 mol/L. L'indicateur coloré utilisé est l'héliantine. Questions :
|
|||||
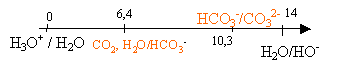
HCO3-+ H3O+ -->CO2 + 2H2O (1)
cette constante est grande et en conséquence la réaction (1) est totale. la solution S1 contient deux acides qui peuvent réagir avec la soude: l'acide chlorhydrique en excès l'acide faible CO2, H2O. ce dernier est éliminer lors du chauffage durant 3 à 4 minutes.
H3O+ + HO- --> 2H2O à l'équivalence les quantités de matière d'acide et de base ajouté sont stoéchiomètriques. Avant l'équivalence l'acide est en excès, après l'équivalence la base est en excès. à l'équivalence : Qté de matière d'acide (mmol): volume (mL) * concentration (mol/L) = CV Quantité de matière de soude (mmol) : VeC2. CV=VeC2 soit C= VeC2 / V = 13,6*0,1/20=0,068 mol/L. soit 0,068 *0,2 = 1,36 10-2 mol d'ion oxonium dans S2. Qté totale d'acide chlorhydrique ajouté à l'étape (1) : 0,025*1= 2,5 10-2 mol la réaction (1) a donc consommé : 0,025-0,0136 =1,14 10-2 mol d'ion oxonium soit 1,14 10-2 mol d'ion HCO3- contenu dans 1 g de bicarbonate "officinal". masse de bicarbonate(g) = masse molaire (g/mol) fois qté de matière (mol) 84*0,0114= 0,957 g pureté : 95,7 .
|
||||||
|