|
bac Nlle calédonie 11 /2000.
|
||||||||||||
|
||||||||||||
|
|
l'acide picrique se présente sous la forme de cristaux jaunes à température ordinaire. On dispose d'une solution commerciale d'acide picrique à 1%( 1g d'acide picrique pour 100 mL de solution). On veut vérifier l'indication de l'étiquette du flacon en effectuant un dosage de cette solution commerciale par de la soude. On donne la zone de virage de quelques
indicateurs colorés.
étude théorique préalable : La courbe ci dessous représente une simulation du suivi pHmétrique de la réaction entre une solution d'acide picrique et une solution de soude de même concentration 0,01 mol/L. 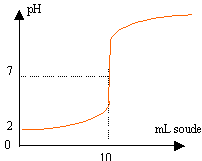
dosage d'essai : Un élève prèlève un volume v=20 mL de la solution commerciale à l'aide de ....(1)..., le verse dans un bécher et ajoute un indicateur coloré. Il remplit ....(2) .... avec la solution de soude de concentration C1= 1 mol/L. Il verse progressivement la solution S1; le changement de couleur de l'indicateur est obtenu pour un volume V1 =0,8 mL.
dosage de précision: L'élève réalise le dosage avec la solution S2. Le volume versé à l'équivalence est V2=17,7 mL.
|
|||||||||||
|
acide de Brönsted: espèce ion ou molécule susceptible de céder un proton. le pH initial vaut 2 alors que la concentration de l'acide est c =10-2 mol/L. Le pH d'une solution d'acide fort est donné par pH=-log c, relation vérifiée ici. le pH à l'équivalence est égal à 7 : donc dosage acide fort base forte. AH + H2O --> A- + H3O+, réaction totale pour un acide fort. la zone de virage de l'indicateur coloré doit contenir le pH du point équivalent: donc bleu de bromothymol.
(1) est une pipette graduée (2) est une burette graduée sur la mesure de V1=0,8 mL on commet une erreur voisine de 0,1 mL soit 12% il faut ajouter à la burette un volume au moins 10 fois plus grand sans toutefois dépasser 25 ou 50 mL (suivant le type de burette). En conséquence la concentration de la solution de soude S1 doit être au moins divisée par 10. facteur de dilution = concentration S1 / concentration S2 = 1 /0,05 = 20 facteur de dilution = volume fiole jaugée / volume pipette = 100 / x?? d'où x = 100/20 = 5 mL - prélever 5 ml (pipette + pipeteur) de solution mère - placer dans une fiole jaugée de 100 mL - compléter à l'eau distillée jusqu'au trait de jauge.
H3O+ + HO- --> 2H2O à l'équivalence les quantités de matière d'acide et de base ajouté sont stoéchiomètriques. Avant l'équivalence l'acide est en excès, après l'équivalence la base est en excès. à l'équivalence : Qté de matière d'acide (mmol): volume (mL) * concentration (mol/L) = CV Quantité de maytière de soude (mmol) : V2C2. CV=V2C2 soit C= V2C2 / V = 17,7*0,05/20=0,044 mol/L. masse d'acide picrique dans 1 L : masse molaire (g/mol) * concentration (mol/L)=229*0,044 =10,07 g soit 1g dans 0,1L. L'indication de l'étiquette est bonne.
|
||||||||||||
|