|
oxydation des ions I- par H2O2.
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
|
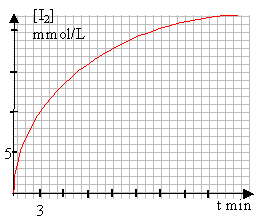
On étudie le cinétique de la réaction d'oxydation des ions iodure I- par l'eau oxygénée H2O2 en milieu acide. Cette réaction est lente ; son equation-bilan est : H2O2 +2I- +2H+ -->I2 +2 H2O On prépare une solution S1 d'eau oxygénée de concentration C1 = 4,5.10-2 mol.L-1 A l'instant t = 0 min, on mélange dans un bécher les 100mL de la solution S1 avec 100mL d'une solution d'iodure de potassuim (K+ +I-) de concentration 0,2 mol.L-1 et 15 mL d'acide sulfurique de concentration 0,5mol.L-1. Pour avoir 10 échantillons identiques du mélange réactionnel initial, on répartit celui-ci dans 10 béchers à raisons de V = 20mL par bécher. A l'instant t = 3min, on ajoute rapidement de la glace au premier bécher et on dose le diiode formé avec une solution de thiosulfate de sodium (2Na+ + S2O32-) de concentration C' = 0,1 mol.L-1, en présence d'empois d'amidon. Soit V' le volume de thiosulfate versé à l'équivalence. Toutes les 3 minutes, on renouvelle l'opération précédente successivement sur le deuxième puis le troisième bécher, etc. La réaction du dosage est rapide et totale. Son équation-bilan est : I2 +2S2O32- -->2I- +S4O62-
|
|||||||||||||||||||||||||
|
eau oxygénée : 0,1 *4,5 10-2 = 4,5 10-3 = 4,5 mmol. ion iodure : 0,1 * 0,2 = 2 10-2
= 20 mmol
soit 4,5 - xmax=0 d'où xmax=4,5 mmol soit 20-2 xmax=0 d'où xmax=10 mmol l'avancement maximal est égal à 4,5
mmol: les ions I- sont en excès.
à l'équivalence du dosage du diiode
formé :
n(I2) = ½C'V' le volume de chaque bécher est V (mL) d'où : [I2] = ½C'V' / V mol /L à la fin de la réaction: n(I2) = 4,5 mmol (voir tableau d'avancement ci dessus) dans 215 mL [I2] fin = 4,5 / 215 = 0,021 mol/L.
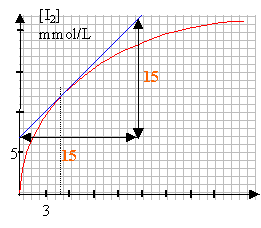
à t= 5 min la vitesse de formation du diiode est égale à : 15 /12 = 1 mmol L-1 min-1.
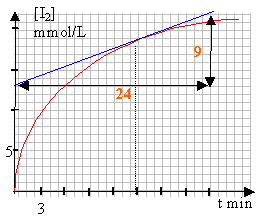
à t= 15 min la vitesse de formation du diiode est égale à : 9 /24 = 0,37 mmol L-1 min-1. Les coefficients étant identiques devant I2 et devant H2O2 dans l'équation bilan, la vitesse de disparition de H2O2 à t= 15 min est égale à la vitesse de formation du diiode à t=15 min. soit: 0,37 mmol L-1 min-1. la vitesse de formation du diiode diminue au cours du temps car la concentration du réactif limitant diminue au cours du temps. En travaillant à une température plus élevée, en utilisant un catalyseur, on augmentera la vitesse de formation du diiode.
|
||||||||||||||||||||||||||
|