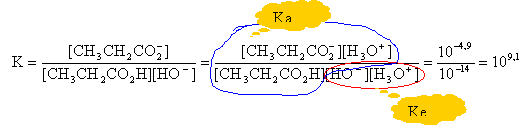|
extraction par solvant bac 09 / 01
|
||||||||||||||
|
||||||||||||||
|
|
I. Extraction par un solvant (5 points) Données:
CH3CH2CO2H / CH3CH2CO2- pKa1= 4,9 H3O+ / H2O pKa2= 0,0 H2O / HO- pKa3=pKe= 14,0 En séance de travaux pratiques, on se propose de procéder à une extraction de l'acide propanoïque par l'éther diéthylique (Nommé communément " éther"). Cette technique consiste à mettre l'acide en contact avec deux solvants non miscibles (non solubles entre eux), ici l'eau et l'éther. L 'acide se dissout dans les deux solvants dans des proportions différentes que l'on cherche à déterminer. 1. Préparation de la solution aqueuse d'acide propanoïque On dispose.: - d'une solution aqueuse S0 d'acide propanoïque de concentration C0 = 10,0 mol. L-1; - du matériel suivant: - pipettes jaugées de 5,00 mL, 10,0 mL, 20,0 mL; - éprouvettes à pied de 10 mL, 100 mL, 200 mL, - bechers de 50 mL, 100,0 mL, 200,0 mL, - fioles jaugées de 50,0 mL, 100,0 mL, 200,0 mL, - poire à pipeter (ou " propipette "). On veut préparer un volume VS = 200,0 mL d'une solution S de concentration C = 1,00 mol.L-1.
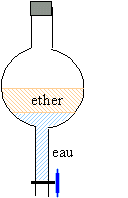
2. Extraction : Mode opératoire.: · Dans une ampoule à décanter, on introduit un volume V = 50 mL de la solution S préparée à la question 1. et un volume V = 50 mL d'éther diéthylique. · On agite pendant au moins 5 minutes en dégazant régulièrement. · On laisse décanter. · On recueille la phase aqueuse dans un becher.
3. Dosage de l'acide propanoïque dans l'eau: On appelle C1 la concentration molaire de l'acide dans la phase aqueuse recueillie, et C2 la concentration de l'acide dans l'éther ; les deux phases ont le même volume V = 50 mL. Afin de déterminer C1 et C2, on procède au dosage de 1'acide dans la phase aqueuse. Pour cela, on prélève un volume Va = 20,0 mL de la solution aqueuse recueillie, on le verse dans un erlenmeyer ; et on y dose l'acide présent par une solution de soude (l'hydroxyde de sodium) de concentration Cb = 0,500 mol. L-1, en présence de phénolphtaléine comme indicateur coloré. Il faut verser un volume (Vb)E = 13,0 mL de solution de soude pour obtenir l'équivalence acidobasique.
|
|||||||||||||
|
facteur de dilution : C0 / C = VS / V0 = 10 /1 = 10 d'où V0 = VSC / C0 = 200/10 = 20 mL prélever 20 mL d'acide propanoïque ( solution mère S0) à la pipette + pipeteur placer un peu d'eau dans une fiole jaugée de 200 mL ajouter les 20 mL de S0. compléter avec de l'eau distilée jusqu'au trait de jauge. utiliser des lunettes de protection et
des gants, le liquide étant corrosif.
retour - menuner l'ampoule à décanter puis ouvrir le robinet : on élimine une éventuelle surpression.
le liquide le moins dense, l'ether
occupe la partie supérieure.
CH3CH2CO2H + HO- -->CH3CH2CO2- + H2O
la constante de la réaction étant grande, la réaction est totale et peut être utilisée pour un dosage. A l'équivalence les quantités de matière d'acide et de soude ajoutée sont égales: C1Va = Cb Vb C1 = 13*0,5 /20 =0,325 mol/L. le volume d'ether est egal au volume d'eau: soit V ce volume n : Qté de matière initiale d'acide dans l'eau n1 : Qté de matière d'acide dans l'eau après extraction n2 Qté de matière d'acide dans l'ether. n=n1+n2 au départ l'acide est dans l'eau: n = CV après extraction : n1 = C1 V et n2 = C2 V CV = C1 V + C2 V soit C2 = C-C1 = 1-0,325 =0,675 mol/L. l'acide est plus soluble dans l'ether que dans l'eau. coefficient de partage : K= C2 / C1 = 0,675 / 0,325 proche de 2.
|
||||||||||||||
|