|
pot catalytique et pollution bac Asie- 06 / 01
|
||||||
|
||||||
|
|
document : Les moteurs à essence rejettent des gaz polluants : monoxyde de carbone CO, hydrocarbures non brûlés ou transformés, oxydes d'azote NO et NO2 issus de l'oxydation à très haute température du diazote de l'air par le dioxygène qui n'a pas participé à la combustion des hydrocarbures. Dans le moteur, plus la température de combustion est élevée, plus la formation d'oxydes d'azote est favorisée. En moyenne sur une heure de fonctionnement, 50 000 L de gaz sortent du pot d'échappement d'une voiture à essence. Le pot catalytique utilisé sur les voitures depuis 1993 contribue à diminuer cette pollution. En fonctionnement normal, 95% des gaz polluants sont dégradés. Le pot catalytique est formé d'une enveloppe en acier inoxydable, d'un isolant thermique en céramique creusé en nid d'abeille et imprègné de métaux précieux tels que le platine Pt, le rhodium Rh, le palladium Pd. Les métaux précieux tappissent des milliards de microalvéoles dont la surface totale peut atteindre 4500m². Lorsque les gaz d'échappement passent à travers le pot catalytique, ces métaux facilitent trois réactions d'où le nom de pot catalytique à trois voies: oxydation du monoxyde de carbone en CO2, la réduction des dioxydes d'azotes en diazote, et l'oxydation des hydrocarbures non brûlés en CO2 et eau. Mais plusieurs critiques sont généralement faîtes aux pots catalytiques: ils exigent une essence sans plomb, ce dernier étant un poison du catalyseur; ils sont responsables d'une hausse de la consommation de carburant. Sa température de fonctionnement optimale étant élevée ( 300°C), l'éfficacité du pot catalytique est très faible les premières minutes de fonctionnement ou au cours de petits trajets surtout en hiver. Il est de plus extrèmement fragile et un mauvais réglage de la combustion peut gravement l'endommager. Les métaux nobles, bien que non consommés, sont difficilement récupérables sur un pot usagé. Des solutions ont été proposées comme l'ajout d'une sonde Lambda chauffée qui contrôle la teneur en oxygène résiduel. Cette mesure permet une régulation du rapport air/ carburant, pour que la combustion soit la plus complète possible limitant ainsi le taux de monoxyde de carbone et d'hydrocarbures non brûlés. De plus le chauffage de la sonde permet au pot catalytique d'être plus rapidement éfficace au démarrage du moteur: 5 secondes au lieu de 2 minutes. Questions sur le texte:
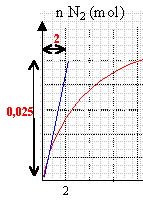
étude d'une cinétique : Le monoxyde d'azote NO peut réagir avec le dihydrogène suivant l'équation bilan: 2 NO (g) +2 H2 (g) --> N2 (g) + 2H2O (g) On étudie au laboratoire dans une enceinte fermée, la réaction du monoxyde d'azote avec le dihydrogène, en partant d'un mélange équimolaire de NO et H2. A l'aide d'un capteur approprié, on trace la courbe donnant la quantité de matière de diazote formé dans le milieu réactionnel en fonction du temps 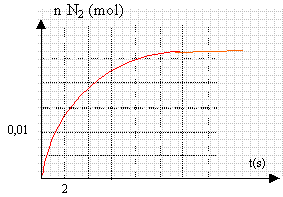
|
|||||
|
oriente une réaction si deux issues sont possibles il n'apparaît pas dans le bilan . "...métaux nobles, bien que non consommés.." "..ces métaux facilitent trois réactions.." "...dont la surface totale peut atteindre 4500m²..." nature du catalyseur : métaux nobles platine, palladium, rodhium. catalyse hétérogène : la catalyseur est un solide et les réactifs sont des gaz. la catalyse a lieu à la surface du catalyseur. Cette catalyse est d'autant plus efficace que la surface du catalyseur est grande. les limites de son utilisation : absence de poison comme le plomb piègeant le catalyseur température élevée, ce qui n'est pas le cas les 2 premières minutes bon réglage du moteur. le facteur cinétique responsable de la formation des oxydes
d'azote est la température.
vitesse instantanée (mol/s): variation de la quantité de matière ( mol) à la date t divisée par la durée (s) de cette variation On peut déterminer graphiquement cette vitesse en traçant la tangente à la courbe à l'instant considéré puis on détermine le coefficient directeur de cette droite. la vitesse instantanée est égale à ce coefficient directeur. d'après le graphe, à t=0 : V f (N2) = 0,025 /2 = 0,0125 mol /s. 50 000 L de gaz sortent du pot chaque heure soit 14 L par seconde en supposant le volume molaire proche de 30 L dans les conditions d'utilisation 14/30 voisin de 0,2 mol de gaz chaque seconde en supposant que la moitié des gaz soit des oxydes d'azote, 0,1 mol/s est dix fois supérieur à la vitesse calculée précédemment. En conséquence cette réaction ne permet pas de réduire sufisamment vite les oxydes d'azote.
|
||||||
|
||||||
| |