| |
cinétique chimique Pondichéry 05/01 sans calculatrice
|
|||||||||||||||||
|
||||||||||||||||||
|
|
courbes catalyseur autocatalyse |
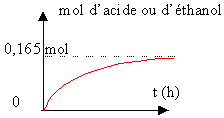
Trois expériences sont réalisées à température et volume constants afin d'étudier l'évolution de trois " systèmes chimiques " au cours du temps. A l'instant t = 0 on mélange les réactifs 1 et 2 suivants : Expérience I 0,50 mol de propanoate d'éthyle 0,50 mol d'eau Expérience II 10 mL d'une solution aqueuse de peroxyde d'hydrogène (ou eau oxygénée) de concentration 1,0 mol/L 50 mL d'une solution aqueuse contenant 0,8mol/L d'ions tartrate en milieu acide à chaud Expérience III 10 mL d'une solution aqueuse de permanganate de potassium de concentration 2,0.10-2 mol/L 30 mL d'une solution aqueuse de peroxyde d'hydrogène de concentration 0,1 mol/L en milieu acide Données :Le rendement d'une réaction d'estérification ou d'hydrolyse est le rapport entre la quantité de produit formé et celle qui aurait été obtenue si la réaction avait été totale.Le rendement d'une estérification, dans le cas d'un mélange équimolaire (avec un alcool primaire ) est égal à 67 %. Le rendement d'une hydrolyse, dans le cas d'un mélange équimolaire ( produisant un alcool primaire)est égal à 33%. Dans le cadre de l'expérience II le potentiel rédox des couples est dans l'ordre décroissant représenté ci-dessous : eau oxygénée / eau ; ion cobalt III / ion cobalt II ; dioxyde de carbone / ion tartrate. En solution aqueuse, les ions permanganate sont violet, les ions cobalt (III) sont verts, les ions cobalt(II) sont roses, toutes les autres entités sont incolores. 1 - Expériences I Pour la réaction I:
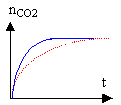
2 - Expérience II L'équation-bilan de la réaction II est la suivante : 5 H2O2 + C4H4O62- + 2 H+ donne 8 H2O + 4 CO2(gaz) a) On prépare un mélange témoin de solution aqueuse de peroxyde d'hydrogène et de solution contenant les ions tartrate en milieu acide à chaud : on observe au bout d'un temps assez long un très léger dégagement gazeux. L'ajout de cristaux de chlorure de cobalt (II) dans un mélange identique au mélange témoin se colore tout d'abord en rose, puis rapidement un dégagement gazeux devient très important et la solution devient verdâtre. Après quelques instants, le dégagement gazeux diminue et la solution reprend la couleur rose. Quel est le rôle joué par les ions Co2+ ? Interpréter les changements de couleurs observés. (Aucune équation-bilan n'est demandée.) b) On a tracé le graphique représentant l'évolution de la quantité nCO2 de dioxyde de carbone formé au cours du temps, sans ajout d'ions Co2+ : on a obtenu le graphique ci dessous. On ajoute des ions Co2+ au mélange réactionnel : reproduire le graphique sur la copie et indiquer sur celui-ci, comment il est éventuellement modifié. 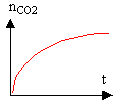
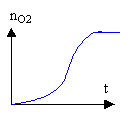
3 Expérience III L'équation bilan de la réaction III est la suivante : 2 MnO4- + 5 H2O2 + 6 H+ donne 2 Mn2+ + 5 O2(gaz) + 8 H2O Cette réaction entre les ions permanganate et l'eau oxygénée a pour catalyseur les ions Mn2+. a) On a tracé le graphique ci-dessous représentant l'évolution de la quantité de dioxygène nO2 formé au cours du temps. Décrire l'évolution de la vitesse de formation du dioxygène au cours du temps et justifier cette évolution. b) Donner la valeur numérique finale de la quantité de dioxygène nO2 formé.
|
||||||||||||||||
| |
CH3-CH2-COO-CH2-CH3 + H2O équilibre avec CH3-CH2-COOH + CH3-CH2OH réaction lente, limitée par l'estérification, athermique.
0,5 * 0,33 = 0,165 mol d'acide ou d'éthanol lorsque l'équilibre est atteint. Les ions cobalt II joue le rôle de catalyseur : ils accélèrent la réaction mais n'interviennent pas dans le bilan final. Le potentiel redox du couple Co3+/Co2+ est intermédiaire entre les potentiels redox des couples faisant intervenir l'eau oxygénée et les ions tartrates. Le catalyseur intervient en remplaçant une réaction lente par deux réactions plus rapides. Puis il est régénéré en fin de réaction. ( d'où le passage par la couleur verte des ions Co3+ en cours de réaction)
courbe bleue (présence du catalyseur) et pointillé rouge sans catalyseur. réaction autocatalysée : la vitesse correspond au coefficient directeur (en valeur absolue) de la tangente à la courbe. facteur n°1 : la vitesse est d'autant plus importante que la quantité de catalyseur est grande: celle ci est nulle au départ puis croît au cours du temps. facteur n°2 : la vitesse est d'autant plus grande que la quantité de matière des réactifs est grande : celle ci est importante au départ puis décroît au cours du temps. Au début, le facteur n°1 l'emporte et la vitesse est faible, mais va croître rapidement dès que la quantité de catalyseur sera grande. vers la fin c'est le facteur n°2 qui l'emporte et la vitesse diminue jusqu'à s'annuler.
|
|||||||||||||||||
| |
|
|||||||||||||||||