| |
comparaison de solutions acido-basiques Pondichéry 05/01 sans calculatrice
|
||||||||||||||
|
|||||||||||||||
|
|
indicateurs colorés pHmètre comparer deux acides |
I - Première partie : identification des solutions 1. Utilisation d'indicateurs colorés On dispose de 3 flacons A, B, C contenant chacun l'une des
solutions suivantes, de même concentration molaire volumique C0,
dans les 3 cas : Solution d'hydroxyde de sodium (ou soude) Solution d'acide chlorhydrique On cherche à identifier le contenu de chaque flacon. On dispose de tubes à essais et de deux indicateurs colorés : le bleu de bromothymol [jaune 6-7,6 bleu] et l'héliantine [rouge 3,1 - 4 ,4 jaune]. On réalise des tests colorimétriques dans les tubes à essais avec ces trois solutions :
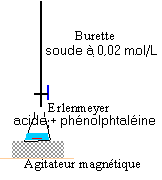
2. Utilisation d'un pH métre: a) Pour permettre d'identifier ces trois solutions, on les dilue cent fois de façon précise et on mesure le pH des solutions diluées. Choisir, dans la liste suivante, la verrerie pour obtenir 100 mL de chacune des solutions diluées. · burette graduée 25 mL ; erlenmmeyers 100mL, 200mL ; pipette jaugées 1mL, 2mL, 5mL, 10mL, 20mL ; bechers 100mL, 500mL; fioles jaugées 50mL, 100mL, 500mL. b) La mesure du pH des trois solutions diluées donne : pHA = 2,0 ; pHB = 2,9 ; pHC = 12,0. Montrer comment ces résultats permettent d'identifier les 3 solutions A, B et C. c) Quelle était la concentration C0 des solutions initiales ? II - Deuxième partie : comparaison de deux acides faibles On dispose de deux solutions d'acides faibles notées 1 et 2 et d'un certain nombre de renseignements concernant chaque solution : Solution 1 : Acide éthanoïque : pKa1 = 4,75 ; C1 = 3,0.10-2 mol/L ; pH1 = 3,1 Solution 2 :acide AH : pKa2 = ? ; C2 = ? ; pH2 = 2,9 On se propose d'effectuer des mesures qui permettent de savoir par deux méthodes différentes lequel de ces deux acides est le plus fort. 1 - Première méthode : détermination de C2. On dose la solution 2 par une solution d'hydroxyde de sodium de concentration CB = 2,0.10-2 mol/L. Le volume à doser est V2 = 20,0 mL. L'équivalence est repérée par le virage d'un indicateur coloré, la phénolphtaléine, dont on rappelle la zone de virage [incolore 8,2- 10 rose ]. Le volume de solution d'hydroxyde de sodium versé à l'équivalence est VBe = 10,0 mL. a) Faire le schéma annoté du dispositif de dosage. b) Quel changement de couleur a-t-on observé à l'équivalence ? c) Écrire l'équation bilan de la réaction de dosage, définir l'équivalence et calculer C2. d) Comment peut-on alors comparer la force de deux acides ?
2 Détermination du pKA du couple de la solution 2 : À 20,0 mL de la solution 2, on ajoute le volume de solution d'hydroxyde de sodium nécessaire pour obtenir la demi-équivalence. On mesure le pH et on trouve pH = 3,75. a) Quel volume de solution d'hydroxyde de sodium a-t-on versé ? b) Que représente la valeur trouvée du pH dans ce cas ? c) Comment peut-on alors comparer la force des deux acides ?
|
|||||||||||||
| |
Ce sont des acides. La solution C a un pH supérieur à 7,6 : le BBT est bleu à pH>7,6 Il s'agit de la solution d'hydroxyde de sodium. En ajoutant beaucoup d'indicateur coloré à une solution contenue dans un tube à essais, on risque de diluer suffisamment et de faire changer le pH initial. facteur de dilution =100 donc le volume à prélever est 100 fois plus petit que le volume final: fiole jaugée de 100 mL et pipette jaugée de 1 mL (+ pipeteur) ou fiole jaugée de 500 mL et pipette jaugée de 5 mL C est un solution de base forte de concentration initiale C0=1 mol/L. Le pH diminue de 2 unités en diluant 100 fois. hydroxyde de sodium A est un acide fort de concentration C0= 1 mol/L. Le pH augmente de 2 unités en diluant 100 fois.. acide chlorhydrique. B est l'acide acétique, acide faible dont le pH varie de moins de 2 unités en diluant 100 fois.
dans l'erlenmeyer la solution reste incolore jusqu'à l'équivalence; puis devient rose dès que la soude est ajoutée en excès. L'acide faible est noté AH : AH+ HO- donne A- + H2O réaction totale A l'équivalence les quantités de réactifs ajoutés sont proportionnelles aux coefficients stoéchiomètriques : CaVa=CbVb Ca=0,02*10/20=0,01 mol/L. Les deux solutions acides n'ont pas la même concentration (C1=0,03 mol/L et C2 = 0,01 mol/L). et pKa2 n'est pas connu. On ne peut donc pas dire quel est l'acide le plus fort à partir des pH mesurés. Par contre la solution n°2 (pH=2,9) est plus acide que la solution S1 (pH=3,1). L'équivalence est atteinte pour un volume de soude de 10 mL. La demi équivalence est atteinte pour un volume de soude de 5 mL. La quantité de matière d'acide restant est alors égale à la quantité de sa base conjuguée A- apparue lors du dosage : en conséquence pH=pKa2=3,75. Un acide est d'autant plus fort qu'il cède plus facilement un proton. Un acide faible est d'autant plus fort que sa constante d'acidité est grande ou que son pKa est petit. L'acide AH (pKa = 3,75) est plus fort que l'acide éthanoïque (pKa = 4,75)
|
||||||||||||||
| |
|
||||||||||||||