|
France 2003
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Le fer est un élément vital...et toxique pour la santé. Il intervient dans de nombreuses réactions biochimiques et permet, notamment, le transport de l'oxygène par l'hémoglobine des globules rouges. Cet exercice concerne l'étude d'un médicament qui contient l'élément fer sous forme d'ions fer (II) : . Il se présente sous forme de comprimés, dont l'enrobage contient un colorant alimentaire (code E 127) de couleur rose. La notice de ce médicament mentionne la composition quantitative d'un comprimé : "sulfate ferreux sesquihydraté : 256,30 mg soit 80mg en ions Fe2+". Nous proposons de vérifier la teneur en élément fer dans ce comprimé. Principe
Données : masse molaire en g.mol-1 : M(Fe) = 55,8 ; M(S) = 32,1 ;M(0)= 16,0 ; M(H) = 1,0 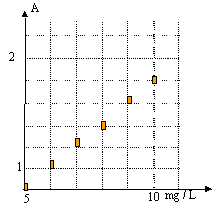
Fe3+ + e- = Fe2+ Préparation de l'échelle de teintes : 2 La verrerie à utiliser pour préparer le mélange n°1 est : - une burette graduée de 25,0 mL (pour la solution S) ; - une pipette jaugée de 2,00 mL (pour la solution d'o-phénanthroline) ; - une pipette jaugée de 1,00 mL (pour la solution d'hydroquinone) ; - une fiole jaugée de 50,0 mL (pour réaliser le mélange n°1) 2.2. Pour préparer le mélange n°1, on réalise une dilution. Or, au cours d'une dilution, la quantité de matière ne varie pas : facteur de dilution : volume final / volume solution S = 2 d'où t1 = 0,5 t= 0,01 g/L La solution incolore d'o-phénanthroline doit réagir avec les ions Fe2+ pour faire apparaître la coloration rouge. Elle ne doit donc pas être en défaut pour réaliser correctement l'échelle de teintes. Le graphe A = f(t) est une droite donc les grandeurs A et t sont proportionnelles, d'où : A = k.t avec k : pente (ou coefficient directeur) de la droite. Pour déterminer k, on prend deux points (sur la droite) éloignés. k = (1,8-0,9 / (10-5) = 0,9 / 5 = 0,18 L mg-1. Détermination expérimentale de la teneur en élément fer : Le colorant rose absorberait dans le même domaine de longueur d'onde que les mélanges : l'échelle de teintes ne serait plus valable. D'après la relation établie à la question ci-dessus : A'0 = 0,18 t'0 d'où t'0 = 1,35 / 0,18 = 7,5 mg /L (concentration massique en Fe2+ dans le mélange) or les 50 mL de mélange résultent de la dilution par 10 de S0 (prélèvement de 5 mL) d'où t0 = 10 t'0 ; t0 = 75 mg.L-1 D'après la définition de la concentration massique : m(Fe2+) = t0 * Vs0 m(Fe2+) = 75 10-3 *1= 75 mg Ecart relatif = (80-75)/75= = 6,25.10-2 soit 6,3% n(Fe2+) = 0,08 / 55,8 = 1,433 10-3 mol M(FeSO4, xH2O) =M= 55,8+32+64+18x =151,8 + 18x g/mol 1,433 10-3 = 0,2536 / M soit M = 0,2536 /1,433 10-3 = 179 g/mol 179 = 151,8+18x d'où x = 1,51.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|