|
Liban 2003
|
||||||||||||||
|
||||||||||||||
|
|
La synthsèse de la vanilline se fait en trois étapes : étape 1 : - synthése de l'acétate d'isoeugénol à partir de l'isoeugénol 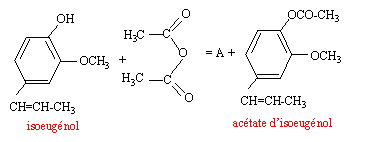 étape 2 : transformation de l'acétate d'isoeugénol en acétate de vanilline étape 3 : action de l'eau sur l'acétate de vanilline 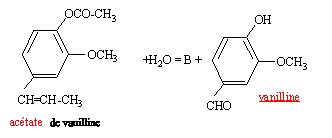
A synthèse de l'acétate d'isoeugénol : mode opératoire - Dans un ballon de 250 mL, introduire 10 g d'isoeugénol, 20
mL d'anhydride acétique, quelques gouutes d'acide orthophosphorique. - refroidir jusqu'à température ambiante. verser le contenu du ballon dans un becher contenant 30 mL d'eau glacée, tout en agitant. - Filtrer sur büchner et laver les cristaux formés avec de l'eau glacée.
Synthèse de la vanilline :
|
|||||||||||||
|
travailler sous hotte avec de la verrerie sèche, mettre des gants et des lunettes. l'anhydride éthanoïque conduit à une réaction totale alors que l'acide éthanoïque conduit à un réaction limitée par l'hydrolyse de l'ester. Le catalyseur augmente la vitesse de la réaction en remplaçant une réaction lente par deux réactions rapides. Le catalyseur est régénéré en fin de réaction. A : acide éthanoïque CH3-COOH. Dans l'eau glacée l'acétate d'isoeugénol est insoluble : des cristaux se forment. Qté de matière : isoeugénol : masse (g) / masse molaire (g/mol) = 10 / 164 = 0,061 mol anhydride éthanoïque : masse (g) = volume (mL) fois densité= 20*1,08 = 21,6 g 21,6 / 102 = 0,212 mol (en excès) Qté de matière d'ester prévue : 0,061 mol soit 0,061*205 = 12,5 g rendement : mase expérimentale / masse théorique = 11,3 / 12,5 = 0,904 ( 90,4 %). B est l'acide éthanoïque CH3-COOH. hydrolyse d'un ester. on déplace l'équilibre dans le sens direct : soit en ajoutant l'un des réactifs en excès, l'eau par exemple soit en éliminant l'un des produits au fur et à mesure qu'il se forme ( distillation par exemple). |
||||||||||||||
|