|
Liban 06/98
|
||||||
|
||||||
|
|
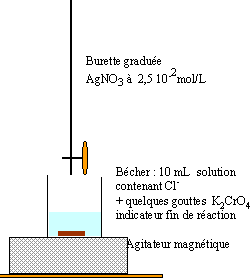
Document : On souhaite vérifier l'information suivante lue dans une encyclopédie : " L'eau de mer renferme environ 35 g/L de sels minéraux et gèle à -1,8°C. La mer commence à geler dans les baies abritées, constituant parfois une banquise. Une glace de mer jeune peut renfermer jusqu'à 22 g/L de sel, une concentration qui va diminuer avec le temps". Mode opératoire : Préparation d'une solution mère notée S1:
Résultats : Questions :
En présence d'ion chlorure les ions argent donnent un solide blanc qui noirçit à l'air, le chlorure d'argent AgCl. Ag+ +
Cl- donne AgCl (solide)
Prélever 10 mL de la solution mère à l'aide d'une pipette graduée + pipeteur Placer dans une fiole jaugée de 100 mL Compléter avec de
l'eau distilée jusqu'au trait de jauge.
réaction du dosage : Ag+ + Cl- donne AgCl (solide) L'ion chromate joue le rôle d'indicateur coloré de fin de réaction ( précipité rouge brique Ag2CrO4) en présence d'ion argent) A l'équivalence les quantités de matière d'ion argent et d'ion chlorure sont égales. Avant l'équivalence l'ion chlorure est en excès ; après l'équivalence l'ion argent est en excès. C'1 V = C0 Ve1. C'1 = 0,025 * 21,9 / 10 = 5,47 10-2 mol/L en tenant compte du facteur de dilution : C1 = 0,547 mol/L. titre massique ( g/L) = concentration volumique ( mol/L) fois masse molaire de NaCl soit 0,547 * 58,5 = 32 g /L.
C'3 V = C0 Ve2. C'3 = 0,025 * 14,9 / 10 = 3,72 10-2 mol/L en tenant compte du facteur de dilution : C3 = 0,372 mol/L. titre massique ( g/L) = concentration volumique ( mol/L) fois masse molaire de NaCl soit 0,372 * 58,5 = 21,7 g /L. ces valeurs confirment les résultats donnés par l'encyclopédie. |
|||||
|
|
||||||
|