|
|
||||||||||
|
||||||||||
|
|
Dans un ballon bicol de 250 mL on introduit environ 20 mL de soude à 1 mol/L, puis V = 2,0 mL de benzaldéhyde et, enfin, quelques grains de pierre ponce. On adapte un refrigérant à reflux et une ampoule de coulée, dans laquelle on verse V1 = 60 mL de solution de permanganate de potassium à C=0,25 mol/L À l'aide d'un chauffe-ballon placé sur un plateau à crémaillère, on porte le mélange réactionnel à ébullition douce, puis on ajoute goutte à goutte la solution oxydante. Aux premières gouttes versées, la solution est verte, puis un précipité marron de dioxyde de manganèse Mn02 se forme. En fin d' addition, on laisse bouillir pendant environ 5 minutes. Pour réduire le permanganate introduit en excès, on ajoute quelques gouttes d'éthanol jusqu'à disparition de la teinte violacée de la phase liquide. On retire le ballon du chauffe-ballon tout en maintenant le reflux. Après refroidissement, on filtre le mélange sur un filtre Büchner : le filtrat est limpide. On le verse alors dans un erlenmeyer contenant 10 mL d'acide chlorhydrique à 5 mol/L L'acide benzoïque précipite ; on place l'erlenmeyer dans un bain eau-glace pour favoriser la précipitation. On filtre alors le mélange sur Büchner; le solide obtenu est rincé, puis séché à l'étuve. Une fois sec, il est pesé; on trouve m = 1,94 g. Données : Masse volumique du benzaldéhyde : 1,04 g/mL. Solubilité dans l'eau de l'acide benzoïque : 2,4 g/L à 20 °C, et 68 g/L à 95 °C ; du benzoate de sodium: 400 g/L à 20 °C. Potentiels standard rédox à 25 °C E°(MnO4- / Mn02) -1,69 V ; E°(C6H5COOH / C6H5CHO) = 0 V ; E°(CH3COOH / CH3CH2OH) = 0,05 V. E°( MnO4- / MnO42- ): 0,56 V
|
|||||||||
|
3 fois{ C6H5 CHO + 3 HO- = C6H5 COO- + 2H2O + 2e- } ( oxydation) 2MnO4-
+ 3 C6H5 CHO
+ HO- --> 2MnO2 + 3C6H5 COO- + 2H2O
C6H5 CHO : masse molaire = 7*12+6+16 = 106 g/mol masse (g) = volume (mL) fois masse volumique (g/mL) = 2* 1,04 = 2,08 g puis 2,08 / 106 = 19,6 mmol ion permanganate : concentration (mol/L) * volume (L) = 0,25 *0,06 = 15 mmol d'après les coefficients de l'équation bilan :
or on dispose de 15 mmol d'ion
permanganate ( soit 2 mmol en excès).
2fois{ MnO4- + e- = MnO42- }( réduction) C6H5 CHO + 3 HO- = C6H5 COO- + 2H2O + 2e- ( oxydation) 2 MnO4- +C6H5 CHO + 3 HO--->2
MnO42- +C6H5 COO- + 2H2O
4 fois{ MnO4- + 3e- + 2H2O = MnO2 + 4 HO- }( réduction) 3 fois{ CH3CH2OH + 5 HO- = CH3COO- + 4e- + 4H2O } ( oxydation) 4 MnO4- + 3 CH3CH2OH --> 4 MnO2 + 3CH3COO- + 4 H2O +HO- l'ion acétate (éthanoate ) est une base : elle va réagir avec l'acide chlorhydrique ajouté pour donner l'acide éthanoïque , soluble dans l'eau alors que l'acide benzoïque formé est quasiment insoluble dans l'eau à 20°. cet ion acétate n'est pas génant
d'autant plus qu'il n' est ni oxydant ni réducteur dans ces conditions.
en présence d'acide chlorhydrique l'ion benzoate, soluble dans l'eau conduit à l'acide benzoïque C6H5 COO- + H3O+ -->C6H5 COOH + H2O réaction acide base. l'acide benzoïque est d'autant moins soluble dans l'eau que la température est plus basse. rendement = masse réelle / masse théorique calculée à partir de 19,6 mmol de benzaldehyde on peut théoriquement obtenir 19,6 mmol d'acide benzoïque masse molaire C6H5 COOH : 7*12+6+32 = 122 g/mol masse théorique : 122 *0,0196 = 2,39 g rendement = 1,94 / 2,39 = 0,81. (81%)
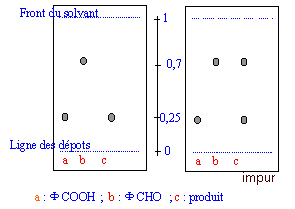
Une chromatographie sur couche mince permet d'identifier et de séparer les constituants d'un mélange en jouant sur la différence de solubilité d'une substance entre un support fixe et une phase mobile ( l'éluant). le révélateur ( ici rayons UV) permet de rendre visible des taches initialement incolores. L'acide benzoïque et le benzaldehyde possédant un noyau benzénique peuvent absorbés les rayons UV. Sur la plaque CCM sensible aux UV on observera donc des taches sombres ( en éclairant avec une lampe UV) aux endroits des taches.
|
||||||||||
|