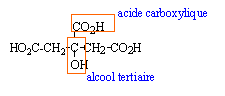|
extraction de l'acide benzoïque d'une boisson - acide citrique
|
||||||
|
||||||
|
|
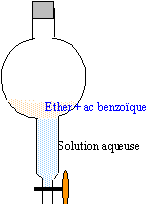
Une boisson au coca contient les ingrédients suivants : eau gazéifiée, sirop de glucose acide phosphorique, acide citrique, benzoate de sodium, caféine. Le glucose, l'acide citrique et le benzoate de sodium sont très solubles dans l'eau et peu solubles dans l'éther éthylique. L'acide benzoique est un solide blanc qui fond à 122°C . L'éther est un liquide de densité 0,7. On désire extraire l'acide benzoique de la boisson par une extraction par l'éther éthylique. Pour cela, on ajoute à la boisson, de l'acide chlorhydrique.
|
|||||
|
mesurer 50 mL de la boisson (éprouvette graduée) et placer dans l'ampoule ; ajouter 10 mL (pipette jaugée) d'ether ; agiter ; retour - menuner l'ampoule ; ouvrir le robinet (les gaz s'échappent) refermer ; retour - menuner ; laisser décanter. ajout d'acide chlorhydrique : en milieu acide la forme C6H5-COOH prédomine alors que la base conjuguée C6H5-COO- est ultraminoritaire ( celle ci est très soluble dans l'eau) l'acide benzoique est très soluble dans l'ether, très peu dans l'eau. utiliser deux solvants non miscibles (eau et ether) et utiliser la différence de solubilité de l'acide entre ces deux solvants, permet de séparer l'acide benzoïque. l'eau liquide le plus dense occupe la partie inférieure surmontée de l'ether ( densité inférieure à 1) avec plusieurs extractions ( mais à partir du même volume total d'ether) on extrait pratiquement tout l'acide benzoïque de la boisson
éther solvant très trés volatil (température d'ébullition sous P=1 bar voisine de 32°C) et inflammable : (ne pas utiliser de flamme dans la salle) l'acide benzoïque peut être identifié : soit par chromatographie sensible aux UV soit par la mesure du point de fusion du solide. acide citrique :
il n'existe pas de carbone asymétrique : aucun atome de carbone ne possède quatre substituants différents. mise en évidence de la fonction aldehyde réductrice du glucose : en présence de liqueur de Felhing , un aldehyde réduit les ions Cu(II) complexés en oxyde de cuivre Cu2O, rouge brique.
|
||||||
|