|
dosage des ions chlorures dans le lait .
|
||||||
|
||||||
|
|
première partie :
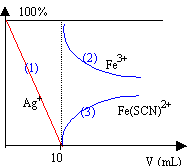
seconde partie : On se propose de doser les ions chlorures du lait, pour cela on mélange 12,5 g de poudre de lait que l'on dissout dans 100 mL d'eau tièdie. On en prélève 20 mL et on ajoute successivement 5 mL d'une solution saturée de permanganate de potassium, 10 mL d'acide nitrique concentré pour faire caillé le lait, en excès 20 mL d'une solution de nitrate d'argent à 0,05 mol/L et enfin 2 grains de pierre ponce. On porte à ébullition douce jusqu'à obtention d'une solution limpide et d'un précipité blanc, puisse on laisse refroidir. On dilue le mélange avec un peu d'eau distillée puis on ajoute 1 mL d'une solution concentrée de nitrate de fer III ( Fe3+ et 3 NO3-) et l'on dose avec 8,9 mL d'une solution de thiocyanate d'ammonium à 0,1 mol/L.
masse atomique molaire : C=12 ; H=1 ; O=16 ; Cl=35,5 g/mol.
|
|||||
|
Le dosage des ions Fe3+ et l'apparition de la couleur rouge commence dès la fin du dosage des ions Ag+. Les ions Fe3+ peuvent servir d'indicateur coloré de fin de réaction lors du dosage des ion argent par les ions thiocyanates. 
4 carbone asymétriques : donc il existe plusieurs isomères optiques ( énantiomères)
Un aldehyde est un réducteur : les ions cuivre II contenus dans la liqueur de Fehling sont réduits à l'état d'oxyde de cuivre I, solide rouge Cu2O. dans le couple redox Ag+ / Ag les ions argent jouent le rôle d'oxydant Les ions argent peuvent être réduits en argent métallique par la fonction aldehyde. l'ion permanganate va oxyder les fonctions oxygénées : l'alcool primaire est oxydé en aldehyde puis en acide carboxylique l'alcol secondaire est oxydé en cétone l'aldehyde est oxydé en acide carboxylique. La solution saturée de permanganate oxyde les fonctions oxygénées des sucres réducteurs afin que ces derniers ne puissent réagir avec l'ion Ag+. la couleur violette est propre à l'ion permanganate : le glucose est un réducteur et réduit MnO4- en Mn2+. Le nitrate d'argent introduit en excès dans le lait précipite les ions chlorures Cl- suivant : Ag+ + Cl- donne AgCl (1) solide blanc qui noirçit à la lumière. Les ions Ag+ en excès sont dosés par les ions SCN- suivant : Ag+ + SCN- donne AgSCN (2) solide blanc Les ions fer III en présence de SCN- jouent le rôle d'indicateur de fin de réaction lors de ce dernier dosage. masse d'ion chlorure dans 100 g de poudre de lait : d'après (2) Qté de matière d'ion Ag+ = Qté de matière d'ion SCN- = 8,9 *0,1 = 0,89 mmol Ag+ en excès. Qté initiale d'ion argent : 20*0,05 = 1 mmol Qté d'ion argent ayant réagi avec les ions chlorures : 1-0,89 = 0,11 mmol d'après (1) Qté de matière d'ion chlorure : 0,11 mmol dans 20 mL de solution. 0,11*100 / 20 = 0,55 mmol ion chlorure dans 0,1 L , dans 12,5 g de poudre de lait 0,55 *100/12,5 = 4,4 mmol d'ion chlorure dans 100g de poudre de lait. masse molaire Cl- : 35,5 g/mmol masse Cl- : 35,5*4,4 10-3 = 0,156 g.
|
||||||
|