|
|
devoirs en
seconde : les ions
|
|
|
|
|
1
Al3+, Na+,
Ca2+, Cl-, SO42-
|
- On donne les ions suivants: Al3+, Na+,
Ca2+, Cl-, SO42-. Ecrire
les formules et les noms de tous les produits chimiques formés à partir
des ions précédents.
corrigé
|
|
 5 fiches de cours interactives 5 fiches de cours interactives

|
|
2
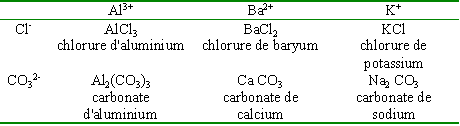
Al3+, K+,
Ba2+, Cl-, CO32-
|
On donne les ions suivants: Al3+, K+, Ba2+,
Cl-, CO32- . Ecrire les formules et
les noms de tous les produits chimiques formés à partir des ions
précédents.
corrigé
|
|
|
|
3
équation
à équilibrer
|
compléter et équilibrer
Pb2+ + I- -->
Ca2+ + P O43- -->
Ba2+ + SO42- -->
Fe2+ + OH- -->
corrigé
|
|
 50
équations à équilibrer et la correction 50
équations à équilibrer et la correction
Pb2+ + 2 I-
--> PbI2
3 Ca2+ + 2 P O43-
--> Ca3(PO4)2
Ba2+ + SO42- --> BaSO4
Fe2+ +2 OH-
-->Fe(OH)2
|
|
4
dissolution
|
Écrivez les équations de dissolution des composés solides
suivants.
- (Ex : chlorure de sodium NaCl --> Na+ + Cl-
)
- Nitrate de potassium.
- Chlorure de calcium.
- phosphate de potassium
- sulfate de sodium
- chlorure d'aluminium
-
corrigé
|
|
|
KNO3 --> K+ + NO3-
CaCl2 --> Ca2+ + 2 Cl-
K3PO4 --> 3K+ + PO43-
Na2SO4 --> 2 Na+ + SO42-
AlCl3 --> Al3+ + 3 Cl-
|
|
|
|
|
5
tableau
|
compléter le tableau suivant:
|
nom de la solution
|
cation
|
anion
|
formule de la solution
|
|
sulfate de zinc
|
Zn2+
|
|
|
|
|
|
K+ et Cl-
|
|
carbonate de sodium
|
Na+
|
|
|
|
chlorure de calcium
|
|
|
|
|
ammonium
|
chlorure
|
|
|
phosphate d'ammonium
|
|
|
|
corrigé
|
|
|
|
nom de la solution
|
cation
|
anion
|
formule de la solution
|
|
sulfate de zinc
|
Zn2+
|
SO42-
|
Zn2+ et SO42-
|
|
chlorure de potassium
|
K+
|
Cl-
|
K+ et Cl-
|
|
carbonate de sodium
|
Na+
|
CO32-
|
2 Na+ et CO32-
|
|
chlorure de calcium
|
Ca2+
|
Cl-
|
Ca2+ et 2 Cl-
|
|
chlorure d'ammonium
|
ammonium
|
chlorure
|
NH4+
et Cl-
|
|
phosphate d'ammonium
|
NH4+
|
PO43-
|
3 NH4+ et
PO43-
|
|
|
6
précipités
|
compléter
|
anion
|
cation
|
équation de formation du précipité
|
|
chlorure
|
Ag+
|
|
|
sulfate
|
Ba2+
|
|
|
hydroxyde
|
Cu2+
|
|
|
hydroxyde
|
Fe3+
|
|
corrigé
|
|
|
Ag+ + Cl- --> AgCl solide blanc
Ba2+ + SO42- --> BaSO4
solide blanc
Cu2+ + 2 OH- -->Cu(OH)2
solide bleu
Fe3+ + 3 OH- -->Fe(OH)3
solide rouille
|
|
7
identier
des solutions
|
On possède des solutions
contenues dans des flacons dont les étiquettes ont été perdues. On
repère ces solutions par les lettres A, B et C. On sait que parmi ces
trois solutions il y a une solution de chlorure de sodium, une solution
de phosphate de potassium et une solution de nitrate d'argent. Pour
retrouver le nom de chaque solution, on réalise les expériences
suivantes:
- On verse quelques gouttes de la
solution B dans C, on observe un précipité jaune de phosphate d'argent.
-
a ) Indiquer le nom et la
formule des ions constituant ce précipité.
b ) Ecrire l'équation bilan
traduisant la formation de ce précipité.
- On verse quelques gouttes de la
solution C dans A, on observe un précipité blanc de chlorure d'argent
qui noircit à la lumière.
-
a ) Indiquer le nom et la
formule des ions constituant ce précipité.
b ) Ecrire l'équation bilan
traduisant la formation de ce précipité.
- On verse quelques gouttes de la
solution A dans B, on n'observe aucun précipité.
-
a ) Identifier à partir des
expériences précédentes les solutions A, B et C.
b ) Ecrire les formules des trois
solutions.
corrigé
|
|
|
Ag3PO4 : ion phosphate PO43-
et ion argent Ag+
3 Ag+ +PO43- -->Ag3PO4
solide
AgCl : ion argent Ag+ et ion
chlorure Cl-
Ag+ + Cl- --> AgCl solide
A est une solution de chlorure de sodium
NaCl.( Na+ et Cl-)
C est une solution de nitrate d'argent AgNO3.( Ag+
et NO3-)
B est une solution de phosphate de potassium K3PO4.(
3 K+ et PO43-)
|
|
|
|

