|
le craquage ; test à l'eau de brome ; solvants chlorés ; C3H6O ; stéarine ; glucose ; urée ; alcane; oxydation ménagée des alcools ; isomères |
|||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
|
|
Le craquage : Par craquage du cyclooctane C8H16, on obtient uniquement un composé non cyclique de formule C4H8.
corrigé |
||||||||||||||||||||||||||||||||
|
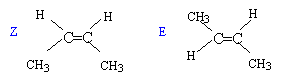
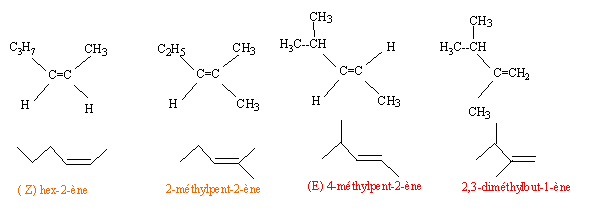
CH2=CH-CH2-CH3 but-1-ène ; CH3CH=CH-CH3 deux isomères Z et E du but-2-ène (CH3)2C=CH2 ; 2-méthylpropène
|
|||||||||||||||||||||||||||||||||
|
Test à l'eau de brome : Afin de déterminer la formule brute d'un alcène X, on mesure la quantité de dibrome consommée par réaction d'addition. On observe que 2,1 g d'alcène décolorent complètement une solution contenant 8,0 g de dibrome.
Données : M(Br2)= 160.0 g.mol-1; M(C) = 12.0 g.mol-1; M(H)= 1.0 g.mol-1. corrigé CnH2n. CnH2n + Br2 --> CnH2nBr2 ( dibromoalcane) Qté matière Br2 : 8/ 160 = 0,05 mol donc 0,05 mol alcène de masse molaire 12 n + 2n = 14 n Qté de matière (mol) = masse (g) / masse molaire (g/mol) 0,05 = 2,1 / (14n) soit n = 3 C3H6 soit CH3-CH=CH2.(propène).
|
|||||||||||||||||||||||||||||||||
|
Solvants chlorés : Le tableau ci dessous rassemble des
données concernant quelques solvants chlorés.
H3C - CCl3
Données : M (CH3OH) = 32,0 g.mol-1.M (CH3Cl) = 50,5 g.mol-1.Volume molaire à 25°C sous 1 bar : Vm = 24,0 L.mol-1. corrigé Gaz pour le chlorométhane ; liquide pour les autres à 25 °C sous 1 bar. Cl2HC - CHCl2 --> Cl2C = CCl2 + H2. Cl3C - CHCl2
--> Cl2C = CCl2+ HCl
Réaction acide base H3O+ + HO- --> 2H2O 220 000 t = 2,2 1011 grammes Qté de matière (mol) = masse (g) / masse molaire (g/mol) 2,2 1011 / 35,5+12+3) = 4,36 109 mol masse de méthanol (g) = masse molaire (g/mol) * Qté de matière (mol) (12+4+16)* 4,36 109 =1,39 1011 g = 139 000 t. volume chlorométhane (L) = Qté matière (mol) fois volume molaire (L/mol) 4,36 109 *24 = 1,05 1011 L = 1,05 108 m3.
|
|||||||||||||||||||||||||||||||||
|
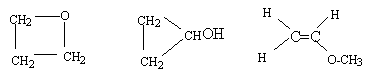
corrigé CH3-CH2-CHO propanal ( aldehyde) CH3-CO-CH3 acétone ou propanone ( cétone) CH2=CH-CH2OH ; CHOH=CH-CH3 ( instable) ; CH2=C(OH)-CH3 (instable) d'autres molécules :
carbone tétragonal ( lié à 4 groupes d'atomes) : le carbone est au centre d'un tétraèdre et les quatre liaisons sont dirigées vers les sommets du tétraèdre carbone trigonal ( lié à 3 groupes d'atomes) : structure triangle plan ( angles proches de 120°)
|
|||||||||||||||||||||||||||||||||
|
La stéarine, constituant de base des bougies, est une espèce chimique organique de formule brute C57 H 110 O6 .
masse atomique molaire C=12 ; O=16 ; H=1 g/mol corrigé masse molaire de la stéarine : 57*12 + 110 + 6*16 = 890 g/mol 57*12*100 / 890 = 76,85 % de carbone 110 *100 / 890= 12,36% d'hydrogène et 16*6 *100 /890 = 10,78 % d'oxygène.
|
|||||||||||||||||||||||||||||||||
|
corrigé glucose CxHyOz masse molaire : 12 x+ y +16 z = 180 12 x /180 = 0,4 --> x = 6 y/180 = 0,067 --> y = 12 16 z / 180 = 0,533 --> z = 6 (C H2O) 6 synthèse utilisant l'énergie solaire: la lumière apporte l'énergie nécessaire à la synthèse. 6 CO2 + 6H2O --> C6 H12 O6 + 6 O2. 3 10-4 / 180 = 1,66 10-6 mol glucose soit 6*1,66 10-6 = 10-5 mol CO2. multiplier par la masse molaire CO2 : 44 10-5 = 0,44 mg. |
|||||||||||||||||||||||||||||||||
|
L'urée fut la première molécule organique synthétisée. Sa masse molaire est de 60 g/mol. Une analyse centésimale permet de déterminer les pourcentages en masse des éléments constitutifs : %C : 20, 0 ; %O : 26,7 ; %H : 6,7 ; %N : 46,6.
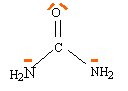
corrigé urée CxHyOzN t masse molaire : 12 x+ y +16 z+ 14 t = 60 12 x /60= 0,2--> x = 1 y/60 = 0,067 --> y = 4 16 z / 60 = 0,267--> z = 1 14t / 60 = 0,464 --> t = 2 H2N- CO-NH2
|
|||||||||||||||||||||||||||||||||
|
L'analyse élémentaire d'une espèce chimique organique s'effectue par la combustion dans le dioxygène. Le carbone et l'hydrogène qu'elle contient se combinent avec l'oxygène pour former du dioxyde de carbone et de l'eau. La mesure des quantités de CO2 et de H2O formées permet de déterminer la formule brute de l'espèce. Une espèce chimique organique gazeuse a pour formule brute CuHv . On réalise la combustion de 10 mL de cette espèce dans une quantité suffisante de dioxygène. On obtient 30 mL de dioxyde de carbone et 40 mL d'eau (gaz) dans les mêmes conditions de température et de pression.
corrigé CuHv + (u +0,25 v)O2 --> u CO2 + ½ v H2O Qté de matière des gaz ( mol) = volume du gaz (L) / volume molaire (L/mol) 0,01 / 25 = 0,4 mmol CuHv. 0,03 /25 = 1,2 mmol CO2 donc u = 3 eau gaz : 0,04/ 25 = 1,6 mmol donc v = 8 C3H8 : propane CH3-CH2-CH3. avancement maxi : 0,4 mmol (ni excès , ni défaut de réactifs d'après le texte) |
|||||||||||||||||||||||||||||||||
corrigé Un alcool primaire, le propan-1-ol, conduit par oxydation ménagée à un aldehyde, le propanal, puis à un acide carboxylique, l'acide propanoïque : on observe alors la décoloration de la solution de permanganate ( passage du violet à l'incolore) MnO4- + 8H+ + 5e- = Mn2+ + 4H2O (1) réduction C3H8O = C3H6O + 2H+ + 2e- (2) oxydation de l'alcool en aldehyde faire l'addition 2 fois (1) + 5 fois (2) 2MnO4- + 6H+ + 5C3H8O = 5C3H6O + 2Mn2+ + 8H2O oxydo-réduction C3H8O +H2O= C3H6O + 4H+ + 4e- (3) oxydation de l'alcool en acide carboxylique faire l'addition 4 fois (1) + 5 fois (2) 4MnO4-
+ 12H+ + 5C3H8O = 5C3H6O
+ 4Mn2+ + 11H2O oxydo-réduction
MnO4- + 8H+ + 5e- = Mn2+ + 4H2O (1) réduction C3H8O = C3H6O + 2H+ + 2e- (2) oxydation de l'alcool en cétone CH3-CO-CH3. faire l'addition 2 fois (1) + 5 fois (2) 2MnO4-
+ 6H+ + 5C3H8O = 5C3H6O
+ 2Mn2+ + 8H2O oxydo-réduction
CH3-CH2-CH2-CH2OH --> CH3-CH2-CH=CH2 + H2O On verse à température modérée quelques gouttes de solution de permanganate de potassium acidifié dans un bécher contenant 20 mL de composé A. La solution reste rose violacé: il n'y a pas de réaction d'oxydo-réduction ( le permanganate est en défaut) le méthanal serait oxydé en acide méthanoïque la pentan-3-one, une cétone ne subit pas d'oxydation ménagée 2-méthyl propan-2-ol : alcool tertiaire ; il ne subit pas d'oxydation ménagée. butan-2-ol, alcool secondaire serait oxydé en cétone. |
|||||||||||||||||||||||||||||||||
|
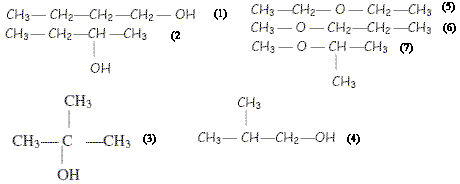
corrigé formule brute des alcools dont la chaîne carbonée saturée comporte quatre atomes de carbone : C4H10O CH3-CH2-CH2-CH2OH : butan-1-ol, alcool primaire CH3-CH2-CHOH-CH3 : butan-2-ol, alcool secondaire CH3-CH(CH3)-CH2OH : 2-méthylpropan-1-ol, alcool primaire CH3-COH(CH3)-CH3 : 2-méthylpropan-2-ol, alcool tertiaire A et C : alcool primaire ou secondaire. B alcool tertiaire : 2-méthylpropan-2-ol test à la liqueur de Fehling : en présence d'un aldehyde réducteur, à chaud, on observe un précipité rouge brique d'oxyde de cuivre (I) Cu2O. test négatif avec A' : A' est une cétone CH3-CH2-CO-CH3 et A est : CH3-CH2-CHOH-CH3 test positif avec C' : C' est un aldehyde à chaîne linéaie CH3-CH2-CH2-CHO donc C est : CH3-CH2-CH2-CH2OH |
|||||||||||||||||||||||||||||||||
|
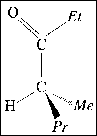
L La molécule ci-contre est la phéromone d'alarme des fourmis du
Texas. Les symboles Me, Et et Pr désignent respectivement les groupes méthyl -CH3, éthyl -C2H5 et propyl -C3H7.
corrigé CH3-CH2-CH2-CH(CH3)-CO-CH2-CH3 : 4-méthylheptan-3-one C8 H16O. Il s'agit d'une cétone: le groupe carbonyle >C=O ne se trouve pas en bout de chaîne. un isomère de chaîne : CH3-CH2-CH2-CH2-CH2-CO-CH2-CH3 :octan-3-one un isomère de position :CH3-CH2-CH2-CH(CH3)-CH2-CO-CH3 : 4-méthylheptan-2-one un isomère de fonction : CH3-CH2-CH2-CH(CH3)-CH(OH)-CH=CH2 : 4-méthylhept-1-ène-3-ol |
|||||||||||||||||||||||||||||||||
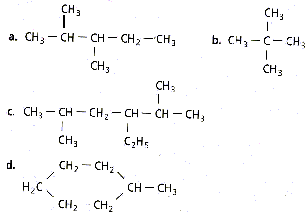
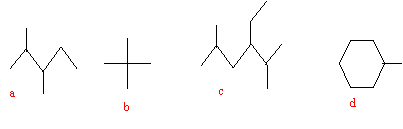
corrigé a : 2,3-diméthylpentane ; b: 2,2-diméthylpropane ; c : 3-éthyl-2,5-diméhtylhexane; d : méthylcyclohexane
|
|||||||||||||||||||||||||||||||||
|
On considère un composé organique de formule CxHyO ; la composition centésimale massique de ce composé est : c : 64,9 % et O : 21,6 %.
Masse volumique du composé : r= 0,785 g/mL ; Vm = 25,0 L/mol. corrigé On note M la masse molaire : M= 12 x + y + 16 g/mol 12 x / %C = y / %H = 16 / %O= M/100 %H = 100 - %C - %O= 100-64,9-21,6 =13,5 % 12 x / 64,9 = y/ 13,5 = 16 / 21,6 = M/100 d'où M= 16/0,216 = 74 g/mol ; y= 16*13,5/21,6 = 10 ; x= 16*64,9/(12*21,6)= 4 C4H10O.
alcools : (1) butan-1-ol ; (2) butan-2-ol ; (4) 2-méthylpropan-1-ol ; (3) 2-méthylpropan-2-ol ; (5, 6, 7) éther (1) et (2) ; (3) et (4) ; (5) et (6) : isomères de position de la fonction (1) et (4) ; (7) et (6) : isomères de constitution ou de chaîne (1) et (5) ; (7) et (3) : isomères de fonction
C4H10O + 6O2 --> 4 CO2 + 5 H2O Qté de matière initiale de C4H10O : masse (g) = volume (mL) * masse volumique (g/mL) = 250*0,785 = 196,25g puis masse (g) / masse molaire (g/mol) = 196,25 / 74 = 2,65 mol.
masse d'eau : Qté de matière (mol)* mase molaire (g/mol) = 13,2 * 18 = 238 g soit 238 mL.
|
|||||||||||||||||||||||||||||||||
|