|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
En vu de construire une échelle de
conductivité molaire ionique,on mesure dans les mêmes conditions les
conductances de solutions électrolytiques de même concentration c =2 10
-3 mol.L. On obtient les résultats suivants :
corrigé |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
G = k s (K en m : cte de la cellule) classement des anions : électrolytes ayant le même cation par exemple K+. les conductances de KCl ; KNO3 et KClO4 conduisent au classement : Cl- > NO3- > ClO4- classement des cations : H3O+ conductivité très supérieure à celles des aux autres cations les conductances de NH4Cl
etKCl conduissent à : NH4+ et K+
conductivité comparable.
k = 1224 10-6 / 0,12 = 0,01 m. concentration en mol / m3 = 2 10-3 *1000 = 2 mol / m3. méthode: diviser G exprimée en S par k=0,01 pour trouver la conductivité de la solution : pour KCl : 306 10-6 / 0,01 = 306 10-4 Sm-1. 306 10-4 = (l K+ + l Cl-) fois la concentration = (l K+ + l Cl-) *2 l K+ + l Cl- =30610-4 /2 = 153 10-4 Sm²/mol l Cl- =(153 -73,5) 10-4 = 79,5 10-4
Sm²/mol .
148 10-4 =l K+ + l NO3- =73,5 10-4 + l NO3-d'où l NO3-= 74,5 10-4 Sm²/mol . 429,5 10-4 =l H+ + l NO3- =l H+ + 74,5 10-4 d'où l H+= 355 10-4 Sm²/mol . 14410-4 =l K+ + l ClO4- =73,5 10-4 + l ClO4- d'où l ClO4- = 70,5 10-4 Sm²/mol .
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
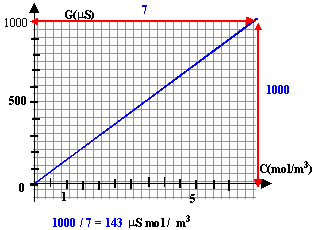
L'hypokaliémie désigne une carence de l'organisme en élément de potassium. Pour compenser rapidement cette carence, on peut utiliser une solution de chlorure de potassium, injectable par voie intraveineuse : le chlorure de potassium Lavoisier, par exemple,est composé de 20 mL contenant m grammes de chlorure de potassium On veut determiner cette masse m. Pour cela, on réalise la manipulation suivante : On ajoute, à l'aide d'une burette graduée, un volume V0 d'une solution de KCl de concentration C0 = 0,1 mol /L dans un volume Veau =500mL d'eau distillé. Après chaque ajout de la solution, on homogénéise puis on mesure a l'aide d'un montage conductimétrique, l' intensité qui circule dans la solution, la tension étant réglée à 1V. On obtient les résultats suivants :
corrigé quantité de matière KCl : C0 V0 volume total de la solution : V+V0 concentration en KCl : quantité de matière divisé par le volume de la solution C0 V0 / (V+V0 )
si la tension est 1 volt alors l'intensité est égale à la conductance en (µS) C0 = 0,1 mol /L = 100 mol / m3 ; C = 100 V0 / (500 +V0) par exemple 100*5 /505 = 0,99 mol / m3.
le graphe est une droite passant par l'origine. lecture graphe à partir de 987 microsiemens on trouve C voisin de 7 mol/m3. et en tenant compte de la dilution : 7*200 = 1400 mol/m3 = 1,4 mol/ L. Qté de matière dans 20 mL : 1,4 * 0,02 = 0,028 mol puis fois la masse molaire de KCl : 39+35,5 = 74,5 g/mol m = 74,5 *0,028 = 2,1 g . |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
A 25°C on mélange un volume V1=50,0 mL d'une solution aqueuse S1 d'hydroxyde de sodium de concentration molaire c1 égale à 1,00.10-3 mol.L-1 avec un volume V2= 200mL d'une solution aqueuse S2 de chlorure de sodium, de concentration molaire c2 égale à 1,52.10-3 mol.L-1.
Données : conductivité molaires ioniques à 25°C(10-4S.m2.mol-1): HO-(aq) : 198.6 ; Na+(aq) : 50.1 ; Cl-(aq) : 76.3 corrigé volume total : 0,25 L ion HO- : 10-3 *0,05 = 5 10-5 mol [HO-] = 5 10-5 / 0,25 = 2 10-4 mol/L = 0,2 mol/m3. ion chlorure : 1,52 10-3 *0,2 = 3,04 10-4 mol [Cl-]= 3,04 10-4 / 0,25 = 1,216 10-3 mol/ L=1,216 mol/m3. ion sodium issus des deux solutions : 5 10-5 + 3,04 10-4 = 3,54 10-4 mol [Na+] = 3,54 10-4 / 0,25 = 1,416 10-3 mol /L= 1,416 mol/ m3. conductivité du mélange : lHO- [HO-] + lCl- [Cl-] + lNa+ [Na+] 198,6 10-4 * 0,2 + 76,3 10-4 *1,216 + 50,1 10-4 *1,416 (39,72 + 92,78 + 70,94) 10-4 =2,03 10-2 S m-1.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On considère 1 L d'une solution de chlorure d'ammonium de concentration C =0,01 mol/L.
Données : > Conductivité molaire ionique : ion chlorure : Cl - = 7,631.10 - 3 S.m².mol - 1 ; ion ammonium : NH 4 + = 7,35.10 - 3 S.m².mol - 1; ionpotassium : K + = 7,35.10 - 3 S.m².mol - 1. corrigé ammonium NH4 + et chlorure Cl-. l'ion ammonium est un acide, ion susceptible de céder H+ pour donner NH3 base conjuguée conductivité : concentration en mol/m3 soit 0,01*1000 = 10 mol/m3. 10 * (7,35 10-3 + 7,63 10 -3 ) = 14,98 10-2 S/m. hydroxde HO- et K+. HO- est une base , espèce susceptible de gagner H+ pour donner H2O HO- + NH4 + donne NH3 + H2O tableau
d'évolution :
ions K+ et Cl- concentrations inchangées.
la conductivité de la solution finale est égale à : faire les produits concentration (mol/m3) par la conductivité molaire ionique de chaque ion puis faire la somme de ces produits. lCl- [Cl-] + lK+ [K+ ] + lNH4+ [NH4 +] avec [Cl-] = 10 mol/m3 ; [K+ ] = 1 mol/m3 ; [NH4 +] =9 mol/m3 7,631.10 - 3 * 10 + 7,35.10 - 3 *1 +7,35.10 - 3 *9 (76,31 + 7,35 + 66,15 ) 10-3 = 14,98 10-2 S/m. la conductivité ionique commence à augmenter lorsque on ajoute plus de 0,01 mol d'hydroxyde de potassium ( l'ion hydroxyde étant alors en excès et sa conductivité molaire ionique est bien supérieure à celle des autres ions). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|