|
|
|||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||
|
|
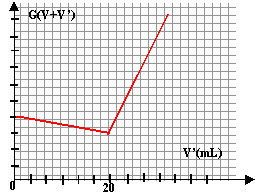
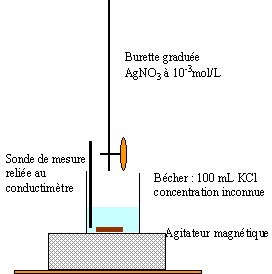
Détermination d'une concentration inconnue : On dispose d'une solution aqueuse de chlorure de potassium, de concentration molaire c inconnue, et on se propose de déterminer cette concentration par conductimétrie. Pour cela, on réalise la manipulation suivante : On prélève un volume V=100mL de la solution de chlorure de potassium, que l'on introduit dans un bécher. On ajoute un barreau aimanté et on place le bécher sur un agitateur magnétique. On introduit alors une cellule de conductimétrie dans ce bécher et on réalise ce montage permettant de relever des mesures de conductance G. Les électrodes de la cellule sont caractérisées par leur surface S et la distance qui les sépare L. Le rapport S/L sera désigné par la constante k=1 cm. On introduit ensuite une solution de nitrate d'argent de concentration molaire c'= 0,001 mol / L dans une burette graduée . On verse alors différents volumes V' de solution de nitrate d'argent dans le bécher et on note les valeurs de conductances correspondantes.
Données. Conductivités molaires ioniques à 25°C (10-4 S.m² mol-1) : lAg+ = 61,9 ;lNO3- = 71,4 ; l Cl-=76,3.
|
||||||||||||||||||||||||||||||||||||||||
Réaction du dosage : Ag+ + Cl-
donne AgCl solide blanc
le béher contient les ions chlorure, nitrate ajouté et potassium Qté de matière (mol) : concentration (mol/L) fois volume (L) V = 0,1 L et C' = 10-3 mol/L. K+ : CV ; [K+] = CV / (V+V') NO3- : C' V' ; [ NO3- ] = C'V' / (V+V') Cl- : CV-C'V' ; [Cl- ] =(CV-C'V' ) / (V+V'). s = S l i Ci s = 10-4 / (V+V') [l K+ CV + 71,4 C'V' + 76,3 ( CV-C'V' )] s = 10-4 / (V+V') [l K+ CV + 71,4 C'V' + 76,3 CV-76,3 C'V' ] s = 10-4 / (V+V') [l K+ CV + 76,3 CV - 4,9 C'V' ] conductance : G = k s .avec k = 1 cm = 10-2 m. G = 10-6 / (V+V') [l K+ CV+ 76,3 CV - 4,9 C'V' ] G (V+V') = 10-6[l K+ CV+ 76,3 CV - 4,9 C'V' ] droite de coefficient directeur - 4,9 C' 10-6 en S.
le bêher contient les ions argent, nitrate ajouté et potassium K+ : CV ; [K+] = CV / (V+V') NO3- : C' V' ; [ NO3- ] = C'V' / (V+V') Ag+: C'V'-C V ; [Ag+ ] =(C'V'-CV ) / (V+V'). s = S l i Ci s = 10-4 / (V+V') [l K+ CV + 71,4 C'V' + 61,9 ( C'V'-CV )] s = 10-4 / (V+V') [l K+ CV + 71,4 C'V' - 61,9 CV+ 61,9 C'V' ] s = 10-4 / (V+V') [l K+ CV -61,9 CV +133,3 C'V' ] conductance : G = k s .avec k = 1 cm = 10-2 m. G = 10-6 / (V+V') [l K+ CV-61,9 CV +133,3 C'V' ] G (V+V') = 10-6[l K+ CV-61,9 CV +133,3 C'V' ] droite de coefficient directeur +133,3 C' 10-6 en S.
à l'équivalence : 10-6[l K+ CV+ 76,3 CV - 4,9 C'V' ] = 10-6[l K+ CV-61,9 CV +133,3 C'V' ] l K+ CV+ 76,3 CV - 4,9 C'V' = l K+ CV-61,9 CV +133,3 C'V' 76,3 CV - 4,9 C'V' = -61,9 CV +133,3 C'V' 76,3 CV + 61,9 CV = 133,3 C'V' + 4,9 C'V' CV = C'V' d'où C = C' V' / V. C = 10-3 *20 /100 = 2 10-4 mol/L.
|
|||||||||||||||||||||||||||||||||||||||||
|
On veut déterminer la concentration molaire d'une solution S de chlorure de potassium (KCl) par conductimétrie. Pour cela on dispose d'une cellule conductimétrique dont les caractéristiques sont : S=1 cm2 et L=1cm. Lorsque la cellule est plongée dans la solution S, on applique entre ses bornes une tension alternative sinusoïdale de valeur efficace U=2V. On relève alors une intensité efficace I=1,8mA dans le circuit de mesure.
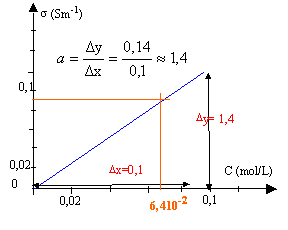
corrigé : conductance (S) = intensité (A) / tension (V) G = 1,8 10-3 / 2 = 9 10-4 S = 0,9 mS. la constante de cellule notée k est égale à : k = l(m) / S (m²) = 0,01 / 10-4 = 100 m-1. conductivité s = k G =100* 9 10-4 = 9 10-2 S m-1.
par le calcul : s = 1,4 c d'où c = 0,09 /1,4 = 0,064 mol/L. |
|||||||||||||||||||||||||||||||||||||||||
|