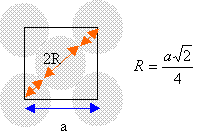|
à propos de l'aluminium (Capes 73)
|
|
I aluminium L'aluminium cristallise dans le système cubique à faces centrées.
corrigé |
|
chaque atome situé sur un sommet appartient à huit mailles et contribue pour 1 /8 éme à la maille. chaque atome situé au centre d'une face appartient à deux mailles et contribue pour ½ à la maille. il y a donc 3+1 = 4 atomes par maille.
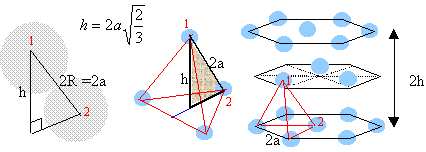
volume de la maille: a3. volume des quatre atomes : 4 *(4/3*3,14* R3) = 3,14 a3 / (3*1,414) compacité : 3,14 / (3*1,414) = 0,74. La maille du système hexagonal compact est un prisme droit à base hexagonale avec un atome à chacun des douze sommets, trois atomes dans le plan méridien et un atome au centre de chaque base. chaque atome situé à un sommet appartient à 6 maille et contribue pour 1/ 6 ème à la maille chaque atome situé dans le plan méridien appartient à une seule maille. chaque atome situé au centre des bdeux bases appartient à deux maille et contribue pour ½ à la maille. donc 12/6 +3 +2*½ = 6 atomes par maille.
volume de la maille : surface hexagone de coté 2a fois la hauteur 2h. surface hexagone = 6 fois surface d'un triangle équilatéral de coté 2a volume = 24*1,414*a3 volume des atomes : 6 *( 4/3 *3,14 *a3) compacité : 3,14 / (3*1,414 )= 0,74. masse volumique de l'aluminium : masse des atomes contenus dans une maille : 6,023 1023 atomes ont une masse de 26,98 g (masse molaire aluminium) 4*26,98 / 6,023 1023 = 1,79 10-22 g = 1,79 10-25 kg volume de la maille (2a)3 = (4,041 10-10 )3= 6,6 10-29 m3. masse volumique : 1,79 10-25 / 6,6 10-29 = 2712 kg m-3.
|
|
II alun d'aluminium et d'ammonium Al2(SO4)3, (NH4)2 SO4, 24 H2O.
III spinelle de magnésium :
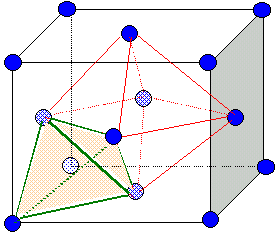
corrigé Les aluns sont des sulfates doubles hydratés de formule générale : M2(SO4)3, N2 SO4, 24 H2O. avec M : Al, Ga, V, Cr, Fe, In, Rh. et N : K, NH4, Rb, Cs. formule d'un autre alun d'aluminium: Al2(SO4)3, K2 SO4, 24 H2O. formules de deux autres aluns: Ga2(SO4)3, Rb2 SO4, 24 H2O. Fe2(SO4)3, (NH4)2 SO4, 24 H2O. site tétraèdrique : les sommets du tétraèdre sont constitués par un sommet du cube et trois atomes au centre de trois faces ayant ce sommet en commun. Il y a huit sites tétraèdriques. site octaèdrique :octaèdre. Il y en a 4 par maille; ils sont situés au centre de la maille et aussi au milieu des arètes.
spinelle de magnésium : par maille il y a 4 ions O2-, un ion Mg2+ et deux ions Al3+. La maille est électriquement neutre: la formule du spinelle est : MgAl2O4 ou MgO, Al2O3.
retour - menu |